SECRETARIA DE ECONOMIA
MODIFICACIÓN a la Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado para alimentos y bebidas no alcohólicas preenvasados-Información comercial y sanitaria, publicada el 5 de abril de 2010.
Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- ECONOMÍA.- Secretaría de Economía.- SALUD.- Secretaría de Salud.- Comisión Federal para la Protección contra Riesgos Sanitarios.
MODIFICACIÓN A LA NORMA OFICIAL MEXICANA NOM-051-SCFI/SSA1-2010, ESPECIFICACIONES GENERALES DE ETIQUETADO PARA ALIMENTOS Y BEBIDAS NO ALCOHÓLICAS PREENVASADOS-INFORMACIÓN COMERCIAL Y SANITARIA, PUBLICADA EN EL DIARIO OFICIAL DE LA FEDERACIÓN EL 05 DE ABRIL DE 2010
ALFONSO GUATI ROJO SÁNCHEZ, Director General de Normas y Presidente del Comité Consultivo Nacional de Normalización de la Secretaría de Economía (CCONNSE) y José Alonso Novelo Baeza, Comisionado Federal de la Comisión Federal para la Protección contra Riesgos Sanitarios y Presidente del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario (CCNNRFS), con fundamento en los artículos 34 fracciones II, VIII, XIII y XXXIII, 39 fracciones XXI y XXVII de la Ley Orgánica de la Administración Pública Federal; 4 de la Ley Federal de Procedimiento Administrativo; 38 fracciones II y IX, 39 fracción V, 40 fracciones VIII, XI y XII, 47 fracciones III, IV y su segundo párrafo de la Ley Federal sobre Metrología y Normalización (LFMN); 31 y 34 del Reglamento de la Ley Federal sobre Metrología y Normalización; 36 fracciones I, IX y X del Reglamento Interior de la Secretaría de Economía; la Secretaría de Salud por conducto de la Comisión Federal para la Protección contra Riesgos Sanitarios, 3 fracciones XXII y XXIV, 13 apartado A, fracciones I, II, IX y X 17 Bis fracción III, 194, 195, 210, 212, 213, 214, 215, 216 y 393 de la Ley General de Salud; 2 literal C fracción X del Reglamento Interior de la Secretaría de Salud y 3 fracciones I, inciso c y d, II y 10 fracciones IV, VIII y XXV del Reglamento de la Comisión Federal para la Protección contra Riesgos Sanitarios.
CONSIDERANDO
Que es responsabilidad del Gobierno Federal procurar las medidas que sean necesarias para garantizar que los productos que se comercialicen en Territorio Nacional contengan los requisitos necesarios con el fin de garantizar los aspectos de información comercial para lograr una efectiva protección del consumidor;
Que el 8 de noviembre de 2019 se publicó en el Diario Oficial de la Federación el Decreto por el que se reforman y adicionan diversas disposiciones de la Ley General de Salud, en materia de sobrepeso, obesidad y de etiquetado de alimentos y bebidas no alcohólicas que establece un sistema frontal de advertencia.
Que con fecha 4 de octubre de 2019 el Comité Consultivo Nacional de Normalización de la Secretaría de Economía (CCONNSE) y el Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario (CCNNRFS), aprobaron la publicación del Proyecto de modificación a la Norma Oficial Mexicana PROY-NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado para alimentos y bebidas no alcohólicas preenvasados – Información comercial y sanitaria, la cual se realizó en el Diario Oficial de la Federación el 11 de octubre de 2019, con objeto de que los interesados presentaran sus comentarios.
Que durante el plazo de 60 días naturales contados a partir de la fecha de publicación de dicho Proyecto de modificación a la Norma Oficial Mexicana, el Análisis de Impacto Regulatorio a que se refiere el artículo 45 de la Ley Federal sobre Metrología y Normalización, estuvo a disposición del público en general para su consulta; y que dentro del mismo plazo, los interesados presentaron comentarios sobre el contenido del citado Proyecto de modificación a la Norma Oficial Mexicana, mismos que fueron analizados por el grupo de trabajo, realizándose las modificaciones conducentes al Proyecto de modificación a la Norma Oficial Mexicana.
Que con fecha 24 de enero de 2020, el CCONNSE y el CCNNRFS aprobaron la modificación a la Norma Oficial Mexicana, NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado par alimentos y bebidas no alcohólicas preenvasados–información comercial y sanitaria y su respuesta a comentarios recibidos.
Que el Análisis de Impacto Regulatorio a que hace referencia el Capítulo III, del Título Tercero de la Ley General de Mejora Regulatoria, fue sometido a la consideración de la Comisión Nacional de Mejora Regulatoria, emitiéndose el Dictamen Final por parte de dicha Comisión el 26 de marzo de 2020, a través del oficio No. CONAMER/20/1540.
Que la Ley Federal sobre Metrología y Normalización establece que las Normas Oficiales Mexicanas se constituyen como el instrumento idóneo para determinar la información comercial y sanitaria que deben cumplir las etiquetas de los alimentos y bebidas no alcohólicas para dar información al consumidor, por consiguiente, se expide la siguiente modificación a la Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado para alimentos y bebidas no alcohólicas preenvasados–información comercial y sanitaria.
Ciudad de México, a 26 de marzo de 2020.- El Director General de Normas y Presidente del Comité Consultivo Nacional de Normalización de la Secretaría de Economía, Alfonso Guati Rojo Sánchez.- Rúbrica.- El Comisionado Federal para la Protección contra Riesgos Sanitarios y Presidente del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, José Alonso Novelo Baeza.- Rúbrica.
PREFACIO
En la elaboración de la presente Norma Oficial Mexicana participaron de manera voluntaria las siguientes entidades:
- Análisis Técnicos S.A. de C.V. (AGROLAB)
- Asociación Mexicana de Endoscopia Gastrointestinal (AMEG)
- Asociación Nacional de Industriales de Aceites y Mantecas Comestibles, A.C. (ANIAME)
- Asociación Mexicana de Industriales de galletas y Pastas, A.C.(AMEXIGAPA)
- Asociación Mexicana de la Industria Salinera, A.C. (AMISAC)
- Asociación Nacional de Productores de Refrescos y Aguas Carbonatadas (ANPRAC)
- Asociación de Normalización y Certificación, A.C. (ANCE)
- Asociación Nacional de Fabricantes de Chocolates, Dulces y Similares, A.C. (ASCHOCO)
- Asociación de Bebidas Energéticas de México (BENERMEX)
- Asociación Nacional de Tiendas de Autoservicio y Departamentales (ANTAD)
- Cámara de la Industria Alimenticia de Jalisco
- Cámara Nacional de la Industria de Transformación (CANACINTRA)
- Cámara Nacional de Industriales de la Leche (CANILEC)
- Confederación de Cámaras Industriales de los Estados Unidos Mexicanos (CONCAMIN)
- Asociación Nacional de Fabricantes de Chocolates, dulces y similares, A.C (CONFIMEX)
- Consejo Nacional Agropecuario (CNA)
- Confederación Patronal de la República Mexicana (COPARMEX)
- Consejo Mexicano de la Industria de Productos de Consumo A:C: (CONMEXICO)
- Consejo Coordinador Empresarial (CCE)
- Consejo Exportador de Lácteos de los Estados Unidos de América (USDEC)
- Cámara Nacional de la Industria de Aceites y Grasas Comestibles (CANIAG)
- Cámara Nacional de la Industria de Conservas Alimenticias, A.C. (CANAINCA)
- Cámara Nacional de la Industria Panificadora y Similares de México (CANAINPA)
- Cámara Nacional de las Industrias Azucarera y Alcoholera (CNIAA)
- Cámara Nacional del maíz Industrializado (CANAMI)
- Cámara Nacional de la Industria Molinera Del Trigo (CANIMOLT)
- Consejo Mexicano de la Carne (COMECARNE)
- Cámara Nacional de la Industria de Aceites, Grasas, Jabones y Detergentes (CANAJAD)
- El Poder del Consumidor
- Factual Services
- Fondo de las Naciones Unidas para la Infancia (UNICEF)
- Mazapán de la Rosa SA de CV
- Universidad Nacional Autónoma de México (UNAM)
- Instituto Politécnico Nacional (IPN)
- Organización Panamericana de la Salud (OPS)
- Procuraduría Federal del Consumidor (PROFECO)
- Subprocuraduría de Verificación
- Laboratorio Nacional de Protección al Consumidor
- Dirección General de Verificación y Defensa del Consumidor
- Quiero Saber Salud
- Secretaría de Agricultura y Desarrollo Rural. (SADER)
- Subsecretaría de Autosuficiencia Alimentaria
- Dirección General de Normalización Agroalimentaria
- Secretaría de Economía
- Subsecretaría de Industria, Comercio y Competitividad
- Dirección General de Normas
- Director General de Industrias Ligeras
- Subsecretaría de Industria, Comercio y Competitividad
- Subsecretaría de Autosuficiencia Alimentaria
- Subprocuraduría de Verificación
Subsecretaria de Comercio Exterior
- Dirección General de Disciplinas de Comercio Internacional
- Secretaría de Salud
- Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS)
- Subsecretaría de Prevención y Promoción de la Salud
- Dirección General de Promoción de la Salud
- Centro Nacional de Programas Preventivos y Control de Enfermedades (CENAPRECE)
- Coordinación General de los Institutos Nacionales de Salud
- Instituto Nacional de Salud Pública (INSP)
- Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán (INCMNSZ)
- Sociedad Mexicana de Inocuidad y Calidad para Consumidores de Alimentos A.C.
- Salud Crítica
- Tu Derecho a Estar Informado de lo que CONSUMES A.C. (CONSUME)
- Unión Nacional de Cañeros, A.C. (UNC)
- Unión Nacional de Productores de Caña de Azúcar, A.C (UNPCA)
REDUCCIÓN DEL COSTO DE CUMPLIMIENTO DE LAS NUEVAS OBLIGACIONES DE LA PROPUESTA REGULATORIA
Para dar cumplimiento a lo establecido en el artículo 78 de la Ley General de Mejora Regulatoria publicada en el Diario Oficial de la Federación el 18 de mayo de 2018, la Secretaría de Economía y la Secretaría de Salud informan las siguientes acciones:
Derogación de los siguientes numerales o incisos del capítulo 4 Especificaciones, de la Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010 vigente:
- 4.2.9 Etiquetado frontal nutrimental
- 4.2.9.1
- 4.2.9.2
- 4.2.9.3
- 4.2.9.4
- 4.2.9.5
- 4.2.9.6
- 4.2.9.7
- 4.2.9.8
- 4.2.9.9
- 4.2.9.10

- Abrogación del Apéndice A (Normativo) referente al Distintivo Nutrimental.
Lo anterior, resulta en un total de 11 acciones regulatorias derogadas, de las cuales 10 corresponden a los numerales enlistados en el capítulo 4 y, 1 acción regulatoria más, correspondiente al Apéndice Normativo A (Normativo).
Acciones regulatorias adicionales a ser derogadas
Al respecto, dentro del acervo regulatorio de la Dirección General de Normas de la Secretaría de Economía, se encuentran proyectos de normas oficiales mexicanas a modificarse. Uno de ellos es el Proyecto de Norma Oficial Mexicana NOM-152-SCFI-2019 “Ámbar de Chiapas – especificaciones y métodos de prueba (cancelará a la NOM-152-SCFI-2003), con folio de referencia SE/48660 en el portal de la CONAMER. En el proyecto de modificación y su respectivo Análisis de Impacto Regulatorio, ha encontrado la derogación de 12 obligaciones regulatorias para los particulares, manifestadas en métodos de prueba. De dicha carga regulatoria es posible aportar dos acciones adicionales de mejora regulatoria al presente proyecto, referentes a la Conductividad eléctrica y al método de prueba denominado Termogravimétrico, lo cual está detallado en la Tabla 1.
Tabla 1 Métodos de prueba derogados de la NOM-152-SCF-2003I
| Método de prueba derogado |
| Conductividad eléctrica. |
| Termogravimétrico. |
| Total |
Fuente: elaboración propia
Simplificación regulatoria por trámites electrónicos o digitales
En este rubro la Secretaría de Economía emitió el “ACUERDO por el que se da a conocer la plataforma informática denominada Sistema Integral de Normas y Evaluación de la Conformidad (SINEC) a cargo de la Dirección General de Normas de la Secretaría de Economía, así como las reglas para su uso”, publicado en el Diario Oficial de la Federación el 27 de enero de 2020. A través de la cual se podrán presentar y desahogar de manera electrónica un total de 16 trámites.
La Dirección General de Normas de la Secretaría de Economía, dentro de su acervo de trámites ha logrado identificar un área de oportunidad para llevar a cabo la simplificación regulatoria al transitar de los trámites presenciales a los trámites electrónicos o digitales. A fin de dar cumplimiento a los supuestos de mejora regulatoria, se presentan los dos trámites siguientes:
Tabla 2 Trámites electrónicos
| Trámite | Nombre |
| SE-04-002 | Aprobación del modelo o prototipo de instrumentos de medición y patrones sujetos a norma oficial mexicana, previa a su comercialización. |
| SE-04-016 | Otorgamiento de la autorización para el uso del logotipo Hecho en México. |
Fuente: elaboración propia
Acuerdo con información nutrimental
Adicional a lo anterior y en concordancia con las medidas regulatorias abrogadas señaladas anteriormente del numeral 4.2.9 Etiquetado frontal nutrimental, de la NOM-051-SCFI/SSA1-2010 vigente, la entrada en vigor de la propuesta regulatoria contempla la abrogación del:
“ACUERDO por el que se emiten los Lineamientos a que se refiere el artículo 25 del Reglamento de Control Sanitario de Productos y Servicios que deberán observar los productores de alimentos y bebidas no alcohólicas preenvasadas para efectos de la información que deberán ostentar en el área frontal de exhibición, así como los criterios y las características para la obtención y uso del distintivo nutrimental a que se refiere el artículo 25 Bis del Reglamento de Control Sanitario de Productos y Servicios, publicado en el Diario Oficial de la Federación el 15 de abril de 2014.”
Este Acuerdo será abrogado para estar en armonía con las especificaciones de la modificación a la NOM-051-SCFI/SSA1-2010.
ÍNDICE DEL CONTENIDO
- Objetivo y Campo de Aplicación
- Referencias Normativas
- Términos, Definiciones, Símbolos y Abreviaturas
- Especificaciones
- Cálculos
- Declaraciones de Propiedades
- Leyendas
- Verificación y Vigilancia
- Procedimiento para la Evaluación de la Conformidad
- Concordancia con Normas Internacionales
APÉNDICE A (Normativo) - Bibliografía
ARTÍCULOS TRANSITORIOS
Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado para alimentos y bebidas no alcohólicas preenvasados -Información comercial y sanitaria.
1. Objetivo y Campo de Aplicación
Esta Norma Oficial Mexicana tiene por objeto establecer la información comercial y sanitaria que debe contener el etiquetado del producto preenvasado destinado al consumidor final, de fabricación nacional o extranjera, comercializado en territorio nacional, así como determinar las características de dicha información y establecer un sistema de etiquetado frontal, el cual debe advertir de forma clara y veraz sobre el contenido de nutrimentos críticos e ingredientes que representan riesgos para su salud en un consumo excesivo.
La presente Norma Oficial Mexicana no se aplica a:
- los alimentos y las bebidas no alcohólicas preenvasados que estén sujetos a disposiciones de información comercial y sanitaria contenidas en Normas Oficiales Mexicanas específicas y que no incluyan como referencia normativa a esta Norma Oficial Mexicana, o en alguna otra reglamentación federal vigente que explícitamente excluya de su cumplimiento al presente ordenamiento;
- los alimentos y las bebidas no alcohólicas a granel;
- los alimentos y las bebidas no alcohólicas envasados en punto de venta; y
- los demás productos que determine la autoridad competente, conforme a sus atribuciones.
2. Referencias Normativas
Los siguientes documentos referidos, sus modificaciones o los que los sustituyan son indispensables para la aplicación de esta Norma Oficial Mexicana.
| 2.1 NOM-002-SCFI-2011, | Productos preenvasados-Contenido neto-Tolerancias y métodos de verificación, publicada en el Diario Oficial de la Federación el 10 de agosto de 2012.
|
| 2.1 NOM-008-SCFI-2002, | Sistema General de Unidades de Medida, publicada en el Diario Oficial de la Federación el 27 de noviembre de 2002. |
| 2.2 NOM-030-SCFI-2006, | Información comercial-Declaración de cantidad en la etiqueta-Especificaciones, publicada en el Diario Oficial de la Federación el 6 de noviembre de 2006.
|
| 2.4 NOM-043-SSA2-2012, | Servicios básicos de salud. Promoción y educación para la salud en materia alimentaria. Criterios para brindar orientación, publicada en el Diario Oficial de la Federación el 22 de enero de 2013.
|
| 2.5 NOM-086-SSA1-1994 | Bienes y servicios-Alimentos y bebidas no alcohólicas con modificaciones en su composición. Especificaciones nutrimentales, publicada en el Diario Oficial de la Federación el 26 de junio de 1996.
|
| 2.6 NOM-106-SCFI-2017 | Características de diseño y condiciones de uso de la Contraseña Oficial, publicada en el Diario Oficial de la Federación el 8 de septiembre de 2017. |
3. Términos, Definiciones, Símbolos y Abreviaturas
Para los propósitos de esta Norma Oficial Mexicana, se aplican los términos, las definiciones, los símbolos y las abreviaturas siguientes:
3.1 acuerdo
ACUERDO por el que se determinan los aditivos y coadyuvantes en alimentos, bebidas y suplementos alimenticios, su uso y disposiciones sanitarias.
3.2 aditivo aditivos
cualquier sustancia que en cuanto tal no se consume normalmente como alimento, ni tampoco se usa como ingrediente básico en alimentos, tenga o no valor nutritivo, y cuya adición al producto con fines tecnológicos en sus fases de producción, elaboración, preparación, tratamiento, envasado, empaquetado, transporte o almacenamiento, resulte o puede preverse razonablemente que resulte (directa o indirectamente) por sí o sus subproductos, en un componente del producto o un elemento que afecte a sus características (incluidos los organolépticos). Esta definición no incluye “contaminantes” o sustancias añadidas al producto para mantener o mejorar las cualidades nutricionales.
3.3 alimento alimentos
cualquier sustancia o producto sólido, semisólido, natural o transformado, que proporciona al organismo elementos para su nutrición.
3.4 azúcares
todos los monosacáridos y los disacáridos presentes en un alimento o en una bebida no alcohólica.
3.5 azúcares añadidos
azúcares libres agregados a los alimentos y a las bebidas no alcohólicas durante la elaboración industrial.
3.6 azúcares libres
monosacáridos y disacáridos disponibles añadidos a los alimentos y a las bebidas no alcohólicas por el fabricante, más los azúcares que están presentes naturalmente en miel, jarabes y jugos de frutas u hortalizas.
3.7 bebida no alcohólica
cualquier líquido natural o transformado, que proporciona al organismo elementos para su nutrición y que
contiene menos de 2.0 % en volumen de alcohol etílico.
3.8 coadyuvante de elaboración (definición que no se usa dentro del documento)
sustancia o materia, excluidos aparatos, utensilios y aditivos, que no se consume como ingrediente alimenticio por sí misma, y se emplea intencionalmente en la elaboración de materias primas, productos o sus ingredientes, para lograr una finalidad tecnológica durante el tratamiento o la elaboración, que puede dar lugar a la presencia, no intencionada pero inevitable, de residuos o derivados en el producto final.
3.9 consumidor o consumidor final
es la persona física o moral que adquiere o que disfruta como destinatario final de un producto preenvasado.
3.10 contenido
cantidad de producto preenvasado que por su naturaleza puede cuantificarse para su comercialización, por cuenta numérica de unidades de producto.
3.11 contenido neto
cantidad de producto preenvasado que permanece después de que se han hecho todas las deducciones de tara cuando sea el caso.
3.12 declaración de propiedades
cualquier texto o representación que afirme, que sugiera o que implique que un alimento o que una bebida no alcohólica preenvasado tiene cualidades especiales por su origen, por sus propiedades nutrimentales, por su naturaleza, por su elaboración, por su composición o por otra cualidad cualquiera, excepto la marca del producto y el nombre de los ingredientes.
3.13 declaración de propiedades nutrimentales
cualquier texto o representación que afirme, que sugiera o que implique que un alimento o que una bebida no alcohólica preenvasado tiene propiedades nutrimentales particulares, no sólo en relación con su valor energético o con su contenido de: proteínas, grasas, hidratos de carbono, o contenido de vitaminas y nutrimentos inorgánicos (minerales).
No constituye declaración de propiedades nutrimentales:
- la mención de sustancias en la lista de ingredientes ni la denominación o marca del producto preenvasado;
- la mención de nutrimentos como parte obligatoria del etiquetado nutrimental, cuando la adición del mismo sea obligatoria, así como la correspondiente a la información nutrimental complementaria;
- la declaración cuantitativa o cualitativa en la etiqueta de propiedades nutrimentales de algunos nutrimentos o ingredientes, cuando ésta sea obligatoria, de conformidad con los ordenamientos jurídicos aplicables.
3.14 declaración nutrimental
relación o enumeración del contenido de nutrimentos de un alimento o de una bebida no alcohólica preenvasados.
3.15 edulcorantes
sustancias diferentes de los monosacáridos y de los disacáridos, que imparten un sabor dulce a los productos.
[Fuente: acuerdo por el que se determinan los aditivos y coadyuvantes en alimentos, bebidas y suplementos alimenticios, su uso y disposiciones sanitarias publicado en el Diario Oficial de la Federación el 16 de julio de 2012 y sus modificaciones.]
3.16 embalaje
material que envuelve, que contiene y que protege los productos preenvasados, para efectos de su almacenamiento y de su transporte.
3.17 envase
cualquier recipiente, o envoltura en el cual está contenido el producto preenvasado para su venta al consumidor.
3.18 envase múltiple o colectivo
cualquier empaque, recipiente o envoltura en el que se encuentren contenidos dos o más unidades de producto preenvasado, iguales o diferentes, destinados para su venta al consumidor.
3.19 etiqueta
cualquier rótulo, marbete, inscripción, imagen u otra materia descriptiva o gráfica, escrita, impresa, estarcida, marcada, grabada en alto o bajo relieve, adherida, sobrepuesta o fijada al envase del producto preenvasado o, cuando no sea posible por las características del producto, al embalaje.
3.20 fecha de caducidad
fecha límite en que se considera que las características sanitarias y de calidad que debe reunir para su consumo un producto preenvasado, almacenado en las condiciones sugeridas por el responsable del producto, se reducen o eliminan de tal manera que después de esta fecha no debe comercializarse ni consumirse.
3.21 fecha de consumo preferente
fecha en que, bajo determinadas condiciones de almacenamiento, expira el periodo durante el cual el producto preenvasado es comercializable y mantiene las cualidades específicas que se le atribuyen tácita o explícitamente, pero después de la cual el producto preenvasado puede ser consumido.
3.22 fibra dietética
polímeros de hidratos de carbono con diez o más unidades monoméricas, que no son hidrolizados por las enzimas endógenas del intestino delgado humano y que pertenecen a las categorías siguientes:
- polímeros de hidratos de carbono comestibles que se encuentran naturalmente en los alimentos en la forma en que se consumen;
- polímeros de hidratos de carbono obtenidos de materia prima alimentaria por medios físicos, enzimáticos o químicos, y que se haya demostrado que tienen un efecto fisiológico beneficioso para la salud mediante pruebas científicas generalmente aceptadas y aportadas a las autoridades competentes; y
- polímeros de hidratos de carbono sintéticos que se haya demostrado que tienen un efecto fisiológico beneficioso para la salud mediante pruebas científicas generalmente aceptadas aportadas a las autoridades competentes.
3.23 función tecnológica
efecto que produce el uso de aditivo en el producto preenvasado, que proporciona o intensifica su aroma, color o sabor, y/o mejora su estabilidad y conservación, entre otros. Véase aditivo.
3.24 grasas trans
isómeros geométricos de ácidos grasos monoinsaturados y poliinsaturados que poseen en la configuración trans dobles enlaces carbono-carbono no conjugados.
[Fuente: CAC/GL 2/1985, 2. Definiciones]
3.25 hidratos de carbono disponibles
son los hidratos de carbono excluyendo la fibra dietética.
3.26 información nutrimental complementaria
es la información destinada a interpretar la declaración nutrimental de forma específica, sobre el contenido energético y los nutrimentos críticos añadidos en un producto preenvasado según corresponda.
3.27 ingestión diaria recomendada (IDR)
se obtiene sumando las dos desviaciones típicas al promedio de los requerimientos de la necesidad de 97,5% de los individuos en la población. Si se desconoce la desviación típica, el Requerimiento Nutrimental Promedio (RNP) de una población se multiplica por 1,2, suponiendo un coeficiente de variación (desviación típica por 100 dividida entre el promedio) de 10%. Donde RNP es el Requerimiento Nutrimental Promedio de una población que, en combinación con la varianza, describe la variación estadística de los requerimientos individuales.
3.28 ingestión diaria sugerida (IDS)
se usa en lugar de la ingestión diaria recomendada (IDR) en los casos que la información sobre requerimientos es insuficiente.
3.29 ingrediente
cualquier sustancia o producto, incluidos los aditivos que se emplee en la fabricación, elaboración, preparación o tratamiento de un alimento o bebida no alcohólica y esté presente en el producto final, transformado o no.
3.30 ingrediente compuesto
mezcla previamente elaborada de sustancias y de productos que constituye un producto terminado y que se emplea para la fabricación de otro distinto.
3.31 leyendas precautorias
cualquier texto o representación que prevenga al consumidor sobre la presencia de un ingrediente específico o sobre los daños a la salud que pueda originar el consumo de éste.
3.32 lote
la cantidad de un producto elaborado en un mismo ciclo, integrado por unidades homogéneas e identificado con un código específico.
3.33 masa drenada
cantidad de producto sólido o semisólido que representa el contenido de un envase, después de que el líquido ha sido removido por un método previamente establecido.
3.34 medio de cobertura
es aquel líquido que ha sido adicionado a un producto preenvasado en recipientes de cierre hermético y tratamiento hermético.
3.35 niños
grupo etario de más de 36 meses y hasta los 12 años de edad, considerando ambos sexos.
3.36 nombre de uso común
nombre que se le da a un alimento o a una bebida no alcohólica preenvasado de acuerdo con los usos y las costumbres, tal es el caso de waffles, hot cakes, entre otros.
3.37 nutrimento
cualquier sustancia incluyendo a las proteínas, aminoácidos, grasas, hidratos de carbono, agua, vitaminas y nutrimentos inorgánicos (minerales) consumida normalmente como componente de un alimento o bebida no alcohólica que:
- proporciona energía; o
- es necesaria para el crecimiento, el desarrollo y el mantenimiento de la vida; o
- cuya carencia haga que se produzcan cambios químicos o fisiológicos característicos.
3.38 nutrimento crítico
aquellos nutrimentos que cuando son ingeridos por arriba de los valores nutrimentales de referencia son considerados como factores de riesgo asociados con enfermedades no transmisibles; estos son: azúcares libres, grasas saturadas, grasas trans y sodio.
3.39 porción
cantidad de producto que se sugiere consumir o generalmente se consume en una ingestión, expresada en unidades del Sistema General de Unidades de Medida.
3.40 producto a granel
producto colocado en un envase de cualquier naturaleza y cuyo contenido puede ser variable, debiéndose pesar, contar o medir en presencia del consumidor al momento de su venta.
3.41 productos imitación
son los producto preenvasado que son elaborados con ingredientes o procedimientos diversos a los usados en la producción de aquél producto preenvasado con Norma Oficial Mexicana o conforme a lo establecido en el numeral 4.2.1.1.1, al que pretende imitar y cuyo aspecto sea semejante a éste último.
3.42 producto preenvasado
alimentos y bebidas no alcohólicas que son colocados en un envase de cualquier naturaleza, en ausencia del consumidor y la cantidad de producto contenido en él no puede ser alterada, a menos que el envase sea abierto o modificado perceptiblemente.
3.43 Reglamento
Reglamento de Control Sanitario de Productos y Servicios.
3.44 responsable del producto
persona física o moral que importe o que elabore un producto o que haya ordenado su elaboración total o parcial a un tercero.
3.45 sello
elemento gráfico en forma de octágono negro con un contorno blanco y con las especificaciones descritas en el APÉNDICE A (Normativo), usado en el sistema de etiquetado frontal.
3.46 símbolo de la unidad de medida
signo convencional con que se designa la unidad de medida, de conformidad con la NOM-008-SCFI-2002, mencionada en el apartado de referencias.
3.47 sistema de etiquetado frontal
sistema de información situado en la superficie principal de exhibición, el cual muestra de manera veraz, directa, clara, sencilla y visible, cuando un producto preenvasado presenta un contenido en exceso de energía, nutrimento crítico e ingredientes que representen un riesgo a la salud en un consumo excesivo, y el cual comprende los sellos y las leyendas descritas en los numerales 7.1.3 y 7.1.4.
3.5 área frontal de exhibición
Aquella superficie donde se encuentra, entre otra información, la denominación y la marca comercial del producto. A efecto de calcular dicha área, se estará a lo dispuesto en la NOM-030-SCFI-2006, Información comercial-Declaración de cantidad en la etiqueta-Especificaciones, y sus actualizaciones, aplicándosele lo correspondiente al término “superficie principal de exhibición”.
3.48 superficie de información
cualquier área del envase o embalaje distinta de la superficie principal de exhibición.
3.49 superficie principal de exhibición
es aquella área de la etiqueta, exceptuando las áreas de sellado y empalme, donde se encuentra la denominación y la marca comercial del producto, entre otros, y sus dimensiones se calculan conforme a la NOM-030-SCFI-2006 (ver 2.2 Referencias Normativas).
3.50 unidad de medida
valor de una magnitud para la cual se admite por convención que su valor numérico es igual a 1.
3.51 valores nutrimentales de referencia (VNR)
conjunto de cifras que sirven como guía para valorar y para planificar la ingestión de nutrimentos de poblaciones sanas y bien nutridas.
3.52 Símbolos y términos abreviados
| Símbolo | Significado |
| IDR | Ingestión Diaria Recomendada |
| IDS | Ingestión Diaria Sugerida |
| cm² | Centímetro cuadrado |
| kJ | KiloJoule |
| kcal | Kilocaloría |
| L, l | Litro |
| m/m | masa/masa |
| mg | Miligramo |
| mm | Milímetro |
| ml, mL | Mililitro |
| g | Gramo |
| µg | Microgramo |
| % | Porciento |
| VNR | Valor Nutrimental de Referencia |
| Cal | Caloría (Equivalente a una kilocaloría) |
4. Especificaciones
4.1 Requisitos generales del etiquetado
4.1.1 La información contenida en las etiquetas de los alimento y bebidas no alcohólicas preenvasados debe ser veraz y describirse y presentarse de forma tal que no induzca a error al consumidor con respecto a la naturaleza y características del producto.
4.1.2 Los producto preenvasado deben presentarse con una etiqueta en la que se describa o se empleen palabras, ilustraciones u otras representaciones gráficas que se refieran al producto.
Las etiquetas que contengan los productos preenvasados pueden incorporar la descripción gráfica o descriptiva de la sugerencia de uso, empleo o preparación, a condición de que aparezca una leyenda alusiva al respecto.
4.1.3 Los alimentos y bebidas no alcohólicas no deberán describirse ni presentarse con una etiqueta en los que se utilicen palabras, textos, diálogos, ilustraciones, imágenes, denominaciones de origen y otras descripciones que se refieran o sugieran, directa o indirectamente a cualquier otro producto con el que pueda confundirse, o que pueda inducir al consumidor a suponer que el alimento se relaciona en forma alguna con aquel otro producto.
4.1.4 En la etiqueta de los producto preenvasado pueden incluirse sellos o leyendas de recomendación o reconocimiento por organizaciones o asociaciones profesionales cuando presenten la documentación apropiada que soporte con evidencia científica, objetiva y fehaciente, la evaluación del producto de acuerdo con lo establecido en el artículo 32 de la Ley Federal de Protección al Consumidor. Para el otorgamiento del respaldo los productos no deben exceder uno o más de los nutrimentos críticos añadidos establecidos en la Tabla 6, y deben especificar la población objetivo con una condición de salud específica. Se exceptúan las certificaciones de propiedades condicionales señaladas en el numeral 6.2 Declaraciones de propiedades condicionales.
4.1.4. Bis La etiqueta de los producto preenvasados que no contengan los sello s y leyendas precautorias puede declararlo únicamente de forma escrita mediante la frase “Este producto no contiene sellos ni leyendas” y no debe utilizar elementos gráficos o descriptivo alusivos a los mismos. La declaración debe ser colocada en la superficie de información y, su tipografía y tamaño debe ser igual o menor al tamaño mínimo cuantitativo del contenido neto conforme a la NOM-030-SCFI-2006.
4.1.5 Los producto preenvasados que ostenten uno o más sellos de advertencia o la leyenda de edulcorantes, no deben:
- incluir en la etiqueta personajes infantiles, animaciones, dibujos animados, ce lebridades, deportistas o mascotas, elementos interactivos, tales como, juegos visual – espaciales o descargas digitales, que, estando dirigidos a niños, inciten, promueven o fomenten el consumo, compra o elección de productos con exceso de nutrimentos críticos o con edulcorantes, y
- hacer referencia en la etiqueta a elementos ajenos al mismo con las mismas finalidades del párrafo anterior.
La aplicación de este numeral se debe hacer en concordancia con lo dispuesto por otros ordenamientos legales aplicables.
4.2 Salvo lo indicado en el siguiente párrafo, son requisitos obligatorios de información comercial y sanitaria los siguientes
A menos de que se trate de especias y de hierbas aromáticas, los productos pequeños en que la superficie más amplia sea inferior a 10 cm2 podrán quedar exentos de los requisitos: lista de ingredientes, instrucciones de uso, lote y fecha de caducidad o de consumo preferente.
[Modificación publicada en el DOF el 26 de octubre de 2010]
4.2.1 Nombre o denominación de los productos preenvasados
4.2.1.1. La denominación del producto preenvasado debe aparecer en negrillas dentro de la superficie principal de exhibición de la etiqueta, en línea paralela a la base como se encuentra diseñado el producto y cumpliendo con las disposiciones de denominación contenidas en una Norma Oficial Mexicana de producto preenvasado. Parece hace referencia a la norma eliminada NOM-002-SCFI-2011.
Junto a la denominación pueden adicionarse las palabras o frases necesarias para evitar que se induzca al error o engaño al consumidor con respecto a la naturaleza y que incluyen, pero no se limitan a:
- el tipo de medio de cobertura;
- la forma de presentación o su condición;
- en el caso de que haya sido objeto de algún tipo de tratamiento, se puede indicar el nombre de éste, con excepción de aquellos que de acuerdo con los ordenamientos correspondientes sean de carácter obligatorio.
Los elementos descritos anteriormente, forman parte de la denominación del producto preenvasado y deben describirse en forma conjunta, con un tamaño igual o mayor al del dato cuantitativo del contenido neto conforme a la NOM-030-SCFI-2006 (ver 2.2 Referencias Normativas) y con la misma proporcionalidad tipográfica, para ser igualmente visibles en la etiqueta y cumplir con lo establecido en este numeral.
Para el caso de los productos imitación , la denominación del mismo aparecerá en la parte superior izquierda de la superficie principal de exhibición, colocando la palabra IMITACIÓN al principio en mayúsculas, con negrillas en fondo claro en un tamaño del doble al resto de la denominación. No se permite el uso de la palabra imitación en productos preenvasados que cuenten con denominación de origen o indicación geográfica protegida o reconocida por el Estado mexicano.
4.2.1.1.1. La denominación del producto preenvasado debe corresponder a los establecidos en las Normas Oficiales Mexicanas u ordenamientos jurídicos específicos y en ausencia de éstos, se debe usar el siguiente orden de prelación para el nombre de una denominación de producto preenvasado:
- nombre de uso común;
- Descripción de acuerdo con las características básicas de la composición y naturaleza del producto preenvasado, o
- Norma internacional del Codex Alimentarius, en su caso.
4.2.1.1.2. Los productos imitación no deben hacer uso de las palabras tales como “tipo”, “estilo” o algún otro término similar, en la denominación del producto preenvasado o dentro de la etiqueta.
4.2.2 Lista de ingredientes
4.2.2.1. En la etiqueta del producto preenvasado cuya comercialización se haga en forma individual, debe figurar una lista de ingredientes, salvo cuando se trate de alimento de un único ingrediente y no incluya algún aditivo.
4.2.2.1.1 La lista de ingrediente debe ir encabezada o precedida por el término Ingredientes:
4.2.2.1.2 Los ingredientes del alimento o bebida no alcohólica preenvasado deben enumerarse por orden cuantitativo decreciente (m/m).
4.2.2.1.3. Los ingrediente compuesto deben declararse como tal en la lista de ingrediente, siempre que vayan acompañados inmediatamente de una lista entre paréntesis de sus ingredientes por orden decreciente de proporciones (m/m). Cuando un ingrediente compuesto, constituya menos del 5 por ciento del producto preenvasado, no será necesario declarar los ingredientes que lo conforman, salvo los aditivos alimentarios que desempeñan una función tecnológica en el producto terminado, o aditivo e ingredientes que se asocien a reacciones alérgicas.
4.2.2.1.4. Se debe indicar en la lista de ingredientes el agua añadida por orden de predominio, excepto cuando ésta forme parte de un ingrediente compuesto, por ejemplo, de manera enunciativa más no limitativa: la salmuera, el jarabe o el caldo, empleados y declarado como tal en la lista y la que se utilice en los procesos de cocción y reconstitución. No es necesario declarar el agua u otros ingredientes volátiles que se evaporan durante la fabricación.
4.2.2.1.5 Cuando se trate de alimento deshidratados o condensados, destinados a ser reconstituidos, pueden enumerarse sus ingrediente por orden cuantitativo decreciente (m/m) en el producto reconstituido, siempre que se incluya una indicación como la que sigue: “ingredientes del producto cuando se prepara según las instrucciones de la etiqueta”, u otras leyendas análogas.
4.2.2.1.6 En la lista de ingredientes debe emplearse una denominación específica de acuerdo con lo previsto en el punto 4.2.2.1, incluyendo los ingredientes mencionados en 4.2.2.2.3, con excepción de los ingredientes cuyas denominaciones genéricas están señalados en la tabla 1.
Tabla 1 Denominación genérica de ingredientes
| Clases de Ingredientes | Denominación genérica |
| Aceites refinados distintos del aceite de oliva | Aceite seguido del término vegetal o animal, calificado con el término hidrogenado o parcialmente hidrogenado, según sea el caso. |
| Grasas refinadas | Grasas seguido del término vegetal o animal o mixta o compuesta, calificado con el término hidrogenado, según sea el caso. |
| Almidones, distintos a los almidones modificados químicamente. | Almidón |
| Todas las especies de pescado, cuando éste constituya un ingredientes de otro alimento y siempre que en la etiqueta y presentación del producto preenvasado no se haga referencia a una determinada especie de pescado. | Pescado |
| Todos los tipos de carne de aves de corral, cuando dicha carne constituya un ingrediente de otro alimento y siempre que en la etiqueta y la presentación del producto preenvasado no se haga referencia a un tipo específico de carne de aves de corral. | Carne de ave |
| Todos los tipos de quesos, cuando el queso o una mezcla de quesos constituya un ingrediente de otro alimento y siempre que en la etiqueta y la presentación del producto preenvasado no se haga referencia a un tipo específico de queso. | Queso o quesos o mezcla de quesos, según sea el caso. |
| Todas las especias y extractos de especias en cantidad no superior al 2% en peso, solas o mezcladas en el producto preenvasado. | Especia, especias o mezclas de especias según sea el caso. |
| Todas las hierbas aromáticas o partes de hierbas aromáticas en cantidad no superior al 2% en peso, solas o mezcladas en el producto preenvasado. | Hierba aromática, Hierbas aromáticas o mezclas de hierbas aromáticas, según sea el caso. |
| Todos los tipos de preparados de goma utilizados en la fabricación de la goma base para el producto goma de mascar. | Goma de base o Goma base |
| Todos los tipos de sacarosa | Azúcar |
| La dextrosa anhidra y la dextrosa monohidratada | Dextrosa o Glucosa |
| Todos los tipos de caseinatos | Caseinatos |
| Productos lácteos que contienen un mínimo de 50% de proteína láctea (m/m) en el extracto seco | Proteína láctea |
| Manteca de cacao obtenida por presión o extracción o refinada. | Manteca de cacao |
| Todas las frutas confitadas, sin exceder del 10% del peso del producto preenvasado. | Frutas confitadas |
| Todos los condimentos en cantidad no superior al 2% en peso, solos o mezclados en el producto preenvasado. | Condimento, Condimentos o Mezcla de condimentos, según sea el caso. |
| Todos los tipos de microorganismos utilizados en la fermentación de lactosa, siempre que en la etiqueta y la presentación de dicho producto no se haga referencia a un tipo específico de microorganismo. | Cultivo láctico o cultivos lácticos |
| Suero de mantequilla, suero de queso, suero de leche, concentrado de proteína de leche, proteína de suera o lactosa | Sólidos de la leche |
| Todas las especies de chile o mezclas | Chile o Chiles o Mezcla de Chiles |
4.2.2.1.7 No obstante lo estipulado en el punto anterior, la manteca de cerdo, la grasa de bovino o sebo, se deben declarar siempre por sus denominaciones específicas.
4.2.2.1.8 Los azúcares añadidos se deben declarar conforme a lo siguiente:
- agrupados anteponiendo las palabras “azúcares añadidos” seguido de la lista entre paréntesis con las denominaciones específicas de todos los azúcares libres añadidos presentes en el producto preenvasado, excepto de aquellos que formen parte de un ingrediente compuesto, en caso de existir;
- en orden cuantitativo decreciente m/m según corresponda a la suma de todos los azúcares añadidos considerados en el inciso a), y
- cuando existan ingredientes compuestos en los que formen parte varios azúcares añadidos, éstos también deben agruparse dentro del mismo, conforme a lo establecido en los incisos a) y b),
4.2.2.2 Coadyuvantes de elaboración y transferencia de aditivo
4.2.2.2.1 Debe ser incluido en la lista de ingredientes todo aditivoque haya sido empleado en los ingredientes de un alimento o bebida no alcohólica preenvasado y que se transfiera a otro producto preenvasado en cantidad notable o suficiente para desempeñar en él una función tecnológica .
4.2.2.2.2 Están exentos de su declaración en la lista de ingredientes los aditivos transferidos a los alimentos y bebida no alcohólicas preenvasados que ya no cumplen una función tecnológica en el producto terminado, así como los coadyuvantes de elaboración, excepto aquellos que puedan causar hipersensibilidad.
4.2.2.2.3 Se deben declarar todos aquellos ingredientes o aditivos que pueden causar hipersensibilidad, intolerancia o alergia, de conformidad con los ordenamientos jurídicos correspondientes.
- Los siguientes alimentos e ingredientes pueden causar hipersensibilidad y deben declararse siempre:
- Cereales que contienen gluten (trigo, centeno, avena, cebada, espelta o sus cepas híbridas, y productos de estos). Se exceptúan: jarabes de glucosa a base de trigo (incluida la dextrosa), maltodextrinas a base de trigo, jarabes de glucosa a base de cebada.
- Huevos, sus productos y sus derivados.
- Crustáceos y sus productos.
- Pescado y sus productos. Se exceptúan: gelatina de pescado utilizada como soporte de vitaminas, aromatizantes o preparados de carotenoides.
- Moluscos y sus productos.
- Cacahuate y sus productos.
- Soya y sus productos. Se exceptúan: aceite y grasa de soya totalmente refinados; tocoferoles naturales mezclados, d-alfa tocoferol natural, acetato de d-alfa tocoferol natural y succinato de d-alfa tocoferol natural derivados de la soya; fitoesteroles y ésteres de fitoesteroles derivados de aceites vegetales de soya; ésteres de fitoestanol derivados de fitoesteroles de aceite de soya.
- Leche, productos de la leche y derivados lácteos (lactosa incluida). Se exceptúa el lactitol.
- Nueces de árboles y sus productos derivados, tales como las almendras (Prunus amygdalus) y nueces (especies del género Juglans), pero se aplica de modo general a todas las nueces producidas por árboles, incluidas las avellanas (Corylus spp.), pecanas (Carya illinoensis), nuez del Brasil (Bertholletia excelsa), nuez de la india (Anacardium occidentale), castañas (Castanae spp.), nuez de macadamia (Macadamia spp.).
- Sulfito en concentraciones de 10 mg/kg o más.
- Cuando el alimento, ingrediente o derivado sea o contenga alguno de los causantes de hipersensibilidad (alérgenos alimentarios) reconocidos en el listado correspondiente, el o los alérgenos deberán declararse al final de la lista de ingredientes.
- con letra en negrillas de igual o mayor tamaño a las letras de los ingredientes generales;
- anteponiendo la palabra bajo el título “Contiene”, y
- si el ingrediente es un derivado que contiene albúmina, caseína o gluten puede rotularse declarando su origen, como el ejemplo siguiente: contiene: caseína (leche) o caseína de leche.
- Si existe la posibilidad de contaminación durante el proceso de producción o elaboración hasta el envasado, por parte del fabricante, se deberá incluir al final de la lista de ingredientes, la siguiente frase: “Puede contener”, con letra en negrillas, de igual o mayor tamaño a las letras de los ingredientes generales, indicando el alérgeno de que se trate.
4.2.2.2.4. En la declaración de aditivos utilizados en la producción de productos preenvasados, debe utilizarse el nombre común o en su defecto, alguno de los sinónimos establecidos en el acuerdo .
Las enzimas y saborizantes, saboreador o aromatizantes pueden ser declarados como denominaciones genéricas, excepto la cafeína, la cual debe ser declarada de forma específica.
Los saborizantes, saboreadores o aromatizantes pueden estar calificados con los términos “natural”, “idéntico al natural”, “artificial” o con una combinación de los mismos según corresponda, a menos que se destaque su presencia de alguna manera, lo cual obliga a la declaración con el término específico.
4.2.2.3. Etiquetado cuantitativo de los ingredientes
4.2.2.3.1 En todo alimento o bebida no alcohólica preenvasado que se venda como mezcla o combinación, se declarará el porcentaje del ingrediente, con respecto al peso o al volumen que corresponda del ingrediente, al momento de la elaboración del alimento (incluyendo los ingredientes compuestos o categorías de ingredientes), cuando este ingrediente:
- se enfatiza en la etiqueta como presente, por medio de palabras o imágenes o gráficos; o
- no figura en el nombre o denominación del alimento o bebida no alcohólica preenvasado y es esencial para caracterizar al mismo, ya que los consumidor asumen su presencia en el producto preenvasado y la omisión de la declaración cuantitativa de ingredientes engaña o lleva a error al consumidor.
Tales declaraciones no se requieren cuando:
- el ingrediente es utilizado en pequeñas cantidades con el propósito de impartir sabor y/o aroma; Respecto al numeral 4.2.2.3.1 (a):
- La referencia en el nombre del alimento, ingrediente o categoría de ingredientes enfatizados en la etiqueta no requiera una declaración cuantitativa si es que:
La referencia al ingrediente enfatizado no conduce a error o engaño, o crea una impresión errónea en el consumidor respecto a la naturaleza del alimento o bebida no alcohólica preenvasado, porque la variación en la cantidad del ingrediente o ingredientes entre productos no es necesaria para caracterizar al mismo o distinguirlo de similares.
4.2.2.3.2 La información requerida en el numeral 4.2.2.3.1 será declarada en la etiqueta del producto como un porcentaje numérico.
El porcentaje del ingrediente, por peso o volumen, según corresponda, se declarará en la etiqueta muy cerca de las palabras o imágenes o gráficos que enfaticen el ingrediente particular, o al lado del nombre común o denominación del alimento o bebida no alcohólica preenvasado, o adyacente al ingrediente que corresponda en la lista de ingredientes. Se declarará como un porcentaje mínimo cuando el énfasis sea sobre la presencia del ingrediente, y como un porcentaje máximo cuando el énfasis sea sobre el bajo nivel del ingrediente.
Para alimentos que han perdido humedad luego de un tratamiento térmico u otro tratamiento, el porcentaje (con respecto al peso o al volumen) corresponderá a la cantidad del ingrediente o ingredientes usados, en relación con el producto terminado.
4.2.3 contenido neto y masa drenada
4.2.3.1 Debe declararse el contenido neto y cuando aplique, la masa drenada en unidades del Sistema General de Unidades de Medida de conformidad a lo que establece la NOM-030-SCFI-2006, independientemente de que también pueda expresarse en otras unidades (véase Referencias).
4.2.4 Nombre, denominación o razón social y domicilio fiscal
4.2.4.1. En un producto preenvasado, debe indicarse en la etiqueta el nombre, denominación o razón social y domicilio fiscal del responsable del producto de manera enunciativa mas no limitativa: calle, número, código postal y entidad federativa en que se encuentre.
En el caso de los productos importados, el nombre y domicilio del importador, en ambos casos, puede incluirse la expresión “fabricado o envasado por o para”, seguido por el nombre y domicilio según corresponda.
4.2.4.2. Para productos preenvasados importados debe indicarse en la etiqueta el nombre, denominación o razón social y domicilio fiscal del responsable del producto . Esta información puede incorporarse al producto preenvasado en territorio nacional, después del despacho aduanero y antes de la comercialización del producto.
4.2.5 País de origen
4.2.5.1 Los alimento y bebidas no alcohólicas preenvasados nacionales o de procedencia extranjera deben incorporar la leyenda que identifique el país de origen de los productos, por ejemplo: “Hecho en…”; “Producto de…”; “Fabricado en…”, u otras análogas, seguida del país de origen del producto, sujeto a lo dispuesto en los tratados internacionales de que los Estados Unidos Mexicanos sean parte. Se permite el uso de gentilicios y otros términos análogos, siempre y cuando sean precisos y no induzcan a error en cuanto al origen del producto. Por ejemplo: “Producto español”, “Producto estadounidense”, entre otros.
4.2.6 Identificación del lote
4.2.6.1 Cada envase debe llevar grabada o marcada de cualquier modo la identificación del lote al que pertenece, con una indicación en clave que permita su rastreabilidad.
4.2.6.2 La identificación del lote que incorpore el fabricante en el producto preenvasado debe marcarse en forma indeleble y permanente, y no debe ser alterada u ocultada de forma alguna hasta que sea adquirido por el consumidor.
4.2.6.3 La clave del lote debe ser precedida por cualquiera de las siguientes indicaciones: “LOTE”, “Lot”, “L”, “Lote”, “lote”, “lot”, “l”, “lt”, “LT”, “LOT”, o bien incluir una referencia al lugar donde aparece.
4.2.7 fecha de caducidad o de consumo preferente
4.2.7.1 Si no está determinado de otra manera en una Norma Oficial Mexicana la fecha de caducidad o la fecha de consumo preferente deberá cumplir con lo siguiente:
- El fabricante debe declararla en el envase o etiqueta, la cual debe consistir por lo menos de:
- El día y el mes para los productos de duración máxima de tres meses;
- El mes y el año para productos de duración superior a tres meses.
- La fecha debe estar precedida por una leyenda que especifique que dicha fecha se refiere a la fecha de caducidad o al fecha de consumo preferente.
- Para el caso de fecha de caducidad, ésta debe indicarse anteponiendo alguna de las siguientes leyendas, sus abreviaturas o leyendas análogas: “fecha de caducidad ___”, “Caducidad ____”, “Fech Cad ____”, CAD, Cad, cad, Fecha de expiración, Expira, Exp, EXP, exp, Fecha de vencimiento, Vencimiento.
- Para el caso de consumo preferente, ésta debe indicarse anteponiendo alguna de las siguientes leyendas, sus abreviaturas o leyendas análogas: “Consumir preferentemente antes del____”, “Cons. Pref. antes del ___”. y “Cons Pref”.
- Las palabras prescritas en el apartado ii) deberán ir acompañadas de:
- la fecha misma; o
- una referencia al lugar donde aparece la fecha.
Tratándose de productos de importación, cuando el codificado de la fecha de caducidad o de fecha de consumo preferenteno corresponda al formato establecido en el numeral 4.2.7.1 inciso i), éste podrá ajustarse a efecto de cumplir con la formalidad establecida, o en su caso, la etiqueta o el envase debe contener la interpretación de la fecha señalada. En ninguno de estos casos los ajustes serán considerados como alteración.
4.2.7.2 Al declarar la fecha de caducidad o de fecha de consumo preferente se debe indicar en la etiqueta cualquiera de las condiciones especiales que se requieran para la conservación del alimento o bebida no alcohólica preenvasado, si de su cumplimiento depende la validez de la fecha.
Por ejemplo, se pueden incluir leyendas como: “manténgase en refrigeración”; “consérvese en congelación”;
“una vez descongelado no deberá volverse a congelar”; “una vez abierto, consérvese en refrigeración”, u otras análogas.
4.2.7.3 La fecha de caducidad o de fecha de consumo preferente que incorpore el fabricante en el producto
preenvasado no puede ser alterada en ningún caso y bajo ninguna circunstancia.
4.2.7.4 No se requerirá la declaración de fecha de caducidad o fecha de consumo preferente, para:
- Vinagre;
- Sal de calidad alimentaria;
- Azúcar sólido;
- Productos de confitería consistentes en azúcares aromatizados y/o coloreados;
- Goma de mascar.
4.2.8 Productos preenvasados con Norma Oficial Mexicana
4.2.8.1. Los productos preenvasados deben exhibir la contraseña oficial cuando así lo determine la Norma Oficial Mexicana que regule su denominación o la Ley Federal sobre Metrología y Normalización, lo que se hará considerando lo establecido en el numeral 4.2.8.3 de esta Norma Oficial Mexicana y de conformidad a lo establecido en la NOM-106-SCFI-2017 (ver 2.4 Referencias Normativas).
4.2.8.2. Los productos preenvasados, cuya presentación individual indique la leyenda de “No etiquetado para su venta individual” o similar, y requieran usar la contraseña oficial en términos del numeral 4.2.8.1, lo debe hacer únicamente en el empaque múltiple o colectivo.
4.2.8.3. Los productos preenvasados que ostenten la contraseña oficial incluida en un producto preenvasado conforme al numeral 4.2.8.1 deben incluir, ya sea debajo de la contraseña oficial o del lado derecho de la misma, los tres dígitos correspondientes a la clave o código de la norma oficial mexicana específica para la denominación de producto, con la misma proporcionalidad y tipografía.
4.3 Instrucciones para el uso
La etiqueta debe contener las instrucciones de uso cuando sean necesarias sobre el modo de empleo, incluida la reconstitución, si es el caso, para asegurar una correcta utilización del producto preenvasado.
4.4 Información adicional
En la etiqueta puede presentarse cualquier información o representación gráfica, así como materia escrita, impresa o gráfica, siempre que no esté en contradicción con los requisitos obligatorios de la presente Norma Oficial Mexicana, incluidos los referentes a la declaración de propiedades establecidos en el apartado 4.1.1.
4.4.1 Cuando se empleen designaciones de calidad, éstas deben ser fácilmente comprensibles, evitando ser equívocas o engañosas en forma alguna para el consumidor.
4.4.2 Asimismo, en la etiqueta puede presentarse cualquier información o representación gráfica que indique que el envase que contiene el producto preenvasado no afecta al ambiente, evitando que sea falsa o equívoca para el consumidor.
4.5. Etiquetado nutrimental
4.5.1 Componentes
El etiquetado nutrimental es obligatorio en la etiqueta de los productos preenvasados, y comprende la declaración nutrimental y la información nutrimental complementaria.
4.5.2 Declaración nutrimental
Se deben declarar los nutrimentos siguientes, excepto en el producto preenvasado regulado por otros ordenamientos jurídicos aplicables:
- el contenido de energía;
- la cantidad de proteína;
- la cantidad de hidratos de carbono disponibles, indicando la cantidad correspondiente a azúcares y a azúcares añadidos.
- la cantidad de grasas especificando la cantidad que corresponda a grasas saturadas y a grasas trans , no incluyendo las grasas trans presentes en ingredientes lácteos y cárnicos de manera natural.
- la cantidad de fibra dietética;
- la cantidad de sodio;
- la cantidad de cualquier otro nutrimento acerca del cual se haga una declaración de propiedades;
- la cantidad de cualquier otro nutrimento que se considere importante, regulado por los ordenamientos jurídicos aplicables.
4.5.2.1 Cuando se haga una declaración específica de propiedades referente a la cantidad o tipo de hidrato de carbono, pueden indicarse también las cantidades de almidón y, o en su caso, de otros tipos de hidratos de carbono.
4.5.2.2 Cuando se haga una declaración de propiedades con respecto a la cantidad o al tipo de grasas o la cantidad de colesterol deben declararse las cantidades de: grasas monoinsaturadas, grasas poliinsaturadas y colesterol.
4.5.2.3 Quedan exceptuados de incluir la declaración nutrimental los productos siguientes, siempre y cuando no incluyan alguna declaración de propiedades nutrimentales o saludables:
- productos que incluyan un solo ingrediente;
- hierbas, especias o mezcla de ellas;
- extractos de café, granos de café enteros o molidos descafeinados o no y que no contengan ingredientes añadidos diferentes a aromas;
- infusiones de hierbas, té descafeinado o no, instantáneo y/o soluble que no contengan ingredientes añadidos;
- vinagres fermentados y sucedáneos;
- agua para consumo humano y agua mineral natural; y
- los productos en que la superficie más amplia sea inferior a 78 cm2, siempre que incluyan un número telefónico o página Web en la que el consumidor pueda obtener información sobre la declaración nutrimental. Por ejemplo, “Para información sobre declaración nutrimental llame, 800-123-4567”, “Declaración nutrimental disponible en (indicar página Web o número telefónico de atención a clientes) o leyendas análogas”. En este caso, los productos no deben incluir alguna declaración de propiedades en el producto mismo, su etiqueta o su publicidad.
4.5.2.4 Presentación de la declaración nutrimental
4.5.2.4.1 La declaración nutrimental debe hacerse en las unidades que correspondan al Sistema General de Unidades de Medida NOM-008-SCFI-2002, citada en el capítulo de referencias. Adicionalmente, se pueden emplear otras unidades de medidas. Tratándose de vitaminas y de nutrimentos inorgánicos (minerales), éstos se deben sujetar a lo establecido en el inciso 4.5.2.4.2.
4.5.2.4.2 La declaración del contenido energético (Calorías) debe expresarse en kcal (kJ) por 100 g, o por 100 ml, así como por el contenido total del envase. Adicionalmente se puede declarar por porción.
4.5.2.4.3 La declaración sobre la cantidad de proteínas, de hidratos de carbono disponibles, de grasas, de fibra dietética y de sodio que contienen los alimentos y las bebidas no alcohólicas preenvasados debe expresarse en unidades de medida por 100 g o por 100 mL. Adicionalmente se puede declarar por porción en envases que contengan varias porciones, o por envase cuando éste contiene sólo una porción.
4.5.2.4.4 La declaración numérica sobre vitaminas y nutrimentos inorgánicos (minerales) debe expresarse en unidades de medida por 100 g o por 100 mL o en porcentaje de los valores nutrimentales de referencia por porción. Adicionalmente se puede declarar por porción en envases que contengan varias porciones, o por envase cuando éste contiene sólo una porción.
4.5.2.4.5 Para estos casos, se debe emplear la siguiente tabla de ingestión diaria sugerida (IDS) e ingestión diaria recomendada (IDR), para la población mexicana, según corresponda.
Tabla 2-Valores nutrimentales de referencia ponderados para la población mexicana
| nutrimento/unidad de medida | VNR | |
| IDR | IDS | |
| Proteína g/kg de peso corporal | 1 | |
| fibra dietética g | 30 | |
| Vitamina A µg (equivalentes de retinol) | 568 | |
| Vitamina B1 µg (Tiamina) | 800 | |
| Vitamina B2 µg (Riboflavina) | 840 | |
| Vitamina B6 µg (Piridoxina) | 930 | |
| Niacina mg (equivalente a Ácido nicotínico) | 11 | |
| Ácido fólico µg (Folacina) | 380 | |
| Vitamina B12 µg (Cobalamina) | 2,1 | |
| Vitamina C mg (Ácido ascórbico) | 60 | |
| Vitamina D µg (como colecalciferol) | 10 | |
| Vitamina D µg (como colecalciferol) | 5,6 | |
| Vitamina E mg (equivalente a tocoferol) | 11 | |
| Vitamina K. µg | 78 | |
| Ácido pantoténico mg | 4,0 | |
| Calcio mg | 900 | |
| Cobre µg | 650 | |
| Cromo µg | 22 | |
| Flúor mg | 2,2 | |
| Fósforo mg | 664 | |
| Hierro mg | 17 | |
| Magnesio mg | 248 | |
| Selenio µg | 41 | |
| Yodo µg | 150 | |
| Zinc mg | 10 | |
4.5.2.4.6 En los productos destinados a ser reconstituidos o que requieran preparación antes de ser consumidos, la declaración nutrimental debe realizarse de acuerdo con las instrucciones para el uso indicadas en la etiqueta.
4.5.2.4.7 La declaración nutrimental puede presentarse de la siguiente manera o en cualquier otro formato que contenga la información requerida conforme lo indicado en la tabla 3.
4.5.2.4.7. BIS La información impresa en la declaración nutrimental debe presentarse en un tamaño de fuente de cuando menos 1.5 mm de altura, y destacarse en negrillas la declaración y la cantidad el contenido energético, la cantidad de grasa saturada, la cantidad de azúcares añadidos, la cantidad de grasas trans y la cantidad de sodio.
4.5.2.4.7 BIS-1 No obstante lo establecido en 4.5.2.4.7 BIS, la declaración nutrimental debe mostrarse, al menos, en un tamaño de fuente de 1 mm de altura en los siguientes casos:
- productos cuya superficie principal de exhibición sea igual o inferior a 32 cm2,
- productos obligados a declarar más de 20 nutrimentos, y su superficie principal de exhibición, sea igual o inferior a 161 cm2, y
- en envases retornables en los que la información se encuentra en la corcholata o taparrosca.
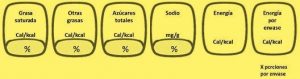
Tabla 3 Presentación de la declaración nutrimental
| Declaración nutrimental | Por 100 g o 100 ml |
| Contenido energético* | _________ kcal (kJ) |
| Proteínas | _________ g |
Grasas totales Grasas saturadas Grasas trans | _________ g _________ g _________ mg |
hidratos de carbono disponibles azúcares azúcares añadidos | _________ g _________ g _________ g |
| fibra dietética | _________ g |
| Sodio | _________ mg |
| Información adicional** | _________ mg, µg o % de VNR |
* De conformidad al 4.5.2.4.2 está declaración debe hacerse también por contenido total del envase.
** Para vitaminas y minerales en caso de porcentaje de VNR debe hacerse por porción.
4.5.2.4.8 La declaración del contenido de vitaminas y de nutrimentos inorgánicos (minerales) es opcional, excepto en los alimentos y en las bebidas no alcohólicas modificados en su composición, debiendo cumplir con la NOM-086-SSA1-1996 (Ver referencias).
4.5.2.4.9 La inclusión de uno de los siguientes nutrimentos no obliga a incluir uno de los otros y sólo se realiza si se tiene asignado un VNR y el contenido de la porción sea igual o esté por arriba del 5% del VNR referido (ya sea IDR o IDS).
Vitamina A (% VNR), Vitamina E (% VNR), Vitamina C (% VNR), Vitamina B1 (% VNR), Vitamina B2 (% VNR), Vitamina B6 (% VNR), Vitamina B12 (% VNR), Vitamina D (% VNR), Vitamina K (% VNR), Ácido pantoténico (% VNR), Ácido fólico (% VNR), Niacina (% VNR), Calcio (% VNR), Fósforo (% VNR), Magnesio (% VNR), Hierro (% VNR), Zinc (% VNR), Yodo (% VNR), Cobre (% VNR), Cromo (% VNR), Flúor (% VNR), Selenio (% VNR).
4.5.2.4.10 Todos o ninguno de los siguientes:
Grasa poliinsaturada ___ g; grasa monoinsaturada __ g; colesterol ___ mg.
4.5.2.4.11 La inclusión de uno de los siguientes no obliga a incluir a los otros:
Almidones ___ g; polialcoholes ___ g; polidextrosas ___ g.
4.5.2.4.12 Se puede señalar el número de porciones contenidas en el envase, usando el término “aproximadamente” o “aprox”.
4.5.2.4.13 Se puede declarar información basada en valores de referencia recomendados para poblaciones distintas a la mexicana, siempre que ésta se presente junto con la información indicada en 4.5.2.4.7 y se le distinga claramente. Dicha información puede presentarse conforme a lo indicado en la tabla 4 o en cualquier otro formato que contenga la información requerida.
Tabla 4-Presentación de la declaración nutrimental de vitaminas y de minerales basada en porcentaje del valor nutrimental de referencia
| Nutrimentos/Porcentaje del VNR (Mex o México) | Nutrimentos/Porcentaje del valor de referencia (Nombre del país) | |||
| Vitamina A | ______ % | Vitamina A | ______ % | |
| Hierro | ______ % | Hierro | ______ % | |
| Vitamina B1 | ______ % | Vitamina B1 | ______ % | |
| Vitamina B2 | ______ % | Vitamina B2 | ______ % | |
| Vitamina B6 | ______ % | Vitamina B6 | ______ % | |
| Vitamina B12 | ______ % | Vitamina B12 | ______ % | |
| Vitamina C | ______ % | Vitamina C | ______ % | |
| Niacina | ______ % | Niacina | ______ % | |
| Ácido fólico | ______ % | Ácido fólico | ______ % | |
| … | … | |||
4.5.2.4.14 Tolerancias y cumplimiento
La Secretaría de Salud puede establecer límites de tolerancia en relación con las exigencias de salud pública, en materia de la declaración nutrimental. La estabilidad en almacén, la precisión de los análisis, el diverso grado de elaboración y la inestabilidad y variabilidad propias del nutrimento en el producto, dependiendo de si el nutrimento ha sido añadido al producto o se encuentra naturalmente presente en él, se regularán a través de normas oficiales mexicanas.
4.5.2.4.15 Los valores de composición bromatológica que figuren en la declaración nutrimental del producto preenvasado, deben ser valores medios ponderados derivados por análisis, bases de datos o tablas reconocidas internacionalmente.
Para cumplir con el contenido declarado de vitaminas y minerales hasta el final de la vida útil se acepta una cantidad superior a lo declarado, dentro de las buenas prácticas de manufactura, siempre y cuando las empresas mantengan los antecedentes técnicos que lo justifiquen.
4.5.2.4.16 Para la expresión de la declaración nutrimental se puede utilizar los parámetros de redondeo de la tabla 5, conforme corresponda al nutrimento respectivo.
Tabla 5. Parámetros de redondeo
nutrimento | Parámetro de redondeo |
| Contenido energético o calorías | < 5 kcal-reportar 0 < 50 kcal-expresar en múltiplos de 5 Cal > 50 kcal-expresar en múltiplos de 10 Cal |
| Proteína | < 0.5 reportar 0 < 1 g-reportar “contiene menos de 1 g” o “menos de 1 g” o > 1 g redondear al entero más cercano |
| Grasas totales y su componentes | < 0.5 g-reportar 0 < 5 g-expresar en múltiplos de 0.5 g > 5 g-redondear al entero más cercano |
| Grasa trans y colesterol | < 2 mg-reportar 0 2 a 5 mg-reportar “menos de 5 mg” > 5 mg-expresar en múltiplos de 5 mg |
| Hidratos de carbono y sus componentes | < 0.5 g – reportar 0 < 1 reportar “contiene menos de 1 g” o “menos de 1 g” |
| fibra dietética | > 1 g redondear al entero más cercano |
Sodio Potasio | < 5 mg-reportar 0 5 mg a 140 mg – expresar en múltiplos de 5 mg > 140 mg – expresar en múltiplos de 10 mg |
| Vitaminas y minerales | Expresar en porcentaje del VNR < 5 % del VNR-reportar 0 < 10 % del VNR-expresar en múltiplos de 2 % > 10 % a 50 % del VNR-expresar en múltiplos de 5% > 50 % de VNR-expresar en múltiplos de 10 % |
4.5.3 Información nutrimental complementaria
Debe incluirse la información nutrimental complementaria en la etiqueta de los productos preenvasados que:
- contengan añadidos: azúcares libres, grasas o sodio; y
- el valor de energía, la cantidad de azúcares libres, de grasa saturada, grasas trans y de sodio cumplan con los perfiles nutrimentales establecidos en la Tabla 6.
Tabla 6 Perfiles nutrimentales para la información nutrimental complementaria
| Energía | azúcares | Grasas saturadas | grasas trans | Sodio | |
Sólidos en 100 g de producto | ≥ 275 kcal totales | ≥ 10 % del total de energía proveniente de azúcares libres | ≥ 10 % del total de energía proveniente de grasas saturadas | ≥ 1 % del total de energía proveniente de grasas trans | ≥ 1 mg de sodio por kcal o ≥ 300 mgBebidas sin calorías:≥ 45 mg de sodio |
| Líquidos en 100 mL de producto | ≥ 70 kcal totales o ≥ 8 kcal de azúcares libres | ||||
| Leyenda a usar | EXCESO CALORÍAS | EXCESO azúcares | EXCESO GRASAS SATURADAS | EXCESO GRASAS | EXCESO SODIO |
4.5.3.1 Para los efectos del inciso anterior se entiende por:
- producto preenvasado añadido de azúcares libres, aquellos a los que durante el proceso de elaboración se les haya añadido azúcares libres, e ingredientes que contengan agregados azúcares libres.
- producto preenvasado añadido de grasas, aquellos a los que durante el proceso de elaboración se haya añadido grasas vegetales o animales, aceites vegetales parcialmente hidrogenados o productos e ingredientes que los contengan agregados; y
- producto preenvasado añadido de sodio, aquellos a los que durante el proceso de elaboración se haya utilizado como ingrediente o aditivo cualquier sal que contenga sodio o cualquier ingrediente que contenga sales de sodio agregadas.
4.5.3.2 En los productos destinados a ser reconstituidos o que requieran preparación antes de ser consumidos, la información nutrimental complementaria se debe declarar conforme a los contenidos de energía, de azúcares libres, grasas saturadas, grasas trans (con excepción de las presentes en productos lácteos y cárnicos de manera natural para el caso de las grasas trans), o de sodio del producto tal como se consume, de acuerdo con las instrucciones indicadas en la etiqueta.
4.5.3.3 Quedan exceptuados de la información nutrimental complementaria los productos siguientes:
- los productos que están exceptuados de la declaración nutrimental, conforme se establece en el numeral 5.2.3 excepto los señalados en el inciso vii;
- las fórmulas para lactantes, las fórmulas para lactantes con necesidades especiales de nutrición, las fórmulas de continuación y las fórmulas de continuación para necesidades especiales de nutrición;
- los alimentos y las bebidas no alcohólicas para lactantes y para niños de corta edad que tengan especificaciones nutrimentales para alguno de los siguientes nutrimentos: grasas, azúcares y sodio; conforme se establece en los ordenamientos jurídicos aplicables.
- aceites vegetales, grasas vegetales o animales; azúcar, miel, sal yodada y sal yodada fluorurada, así como harinas de cereal.
4.5.3.4 Sistema de etiquetado frontal
El sistema de etiquetado frontal incluye la información nutrimental complementaria y las leyendas precautorias descritas en los numerales 7.1.3 y 7.1.4.
4.5.3.4.1 La información nutrimental complementaria debe realizarse utilizando los sellos, según corresponda y conforme a lo establecido en el Apéndice A (Normativo).

4.5.3.4.2 Los productos cuya superficie principal de exhibición sea ≤ 40 cm2 sólo deben incluir un sello con el número que corresponda a la cantidad de nutrimentos que cumplen con el perfil establecido en 4.5.3 Información nutrimental complementaria en un tamaño mínimo de conformidad a lo establecido en la Tabla A1 del APÉNDICE A (Normativo) de la presente Norma.
Aquellos productos cuya superficie principal de exhibición sea ≤ 5 cm2 el sello descrito en el párrafo anterior debe de cumplir con las características descritas en el numeral A.4.4 del APÉNDICE A (Normativo).

4.5.3.4.3 Para el caso de productos en envase retornables utilizados como contenedores para más de un tipo de producto o de sabor, los productores deben expresar únicamente en la parte externa de la tapa el sello correspondiente al número de la cantidad de nutrimentos que cumplen con el perfil establecido en 4.5.3 Información nutrimental complementaria y conforme se establece en
4.5.3.4.2.
4.5.3.4.4 Los productos cuya presentación individual indique la leyenda de “No etiquetado para su venta individual”, o similar, y que se encuentren en un empaque múltiple o colectivo, únicamente éste debe incluir los sellos que correspondan, conforme a lo establecido en los numerales 4.5.3 Información nutrimental complementaria y 4.5.3.4.1.
4.5.3.4.5 Aquellos envases colectivos que contengan más de un tipo de producto deben estar etiquetados de manera individual.
Adicionalmente, el envase colectivo debe incluir tantos sellos como corresponda a los productos que contiene, conforme se establece en 4.5.3 Información nutrimental complementaria de la presente Norma Oficial Mexicana.
4.5.3.4.6 Ubicación y orden de los sellos
El o los sellos deben colocarse en la esquina superior derecha de la superficie principal de exhibición, conforme se establece en el APÉNDICE A (Normativo). En aquellos productos con superficie principal de exhibición menor a 60 cm2 se podrán colocar los sellos en cualquier área de dicha superficie.
Cuando se deban incluir más de un sello, el orden de inclusión debe ser de izquierda a derecha el siguiente:
- EXCESO CALORÍAS
- EXCESO AZÚCARES
- EXCESO GRASAS SATURADAS
- EXCESO GRASAS TRANS
- EXCESO SODIO
4.5.3.4.7 Cuando proceda incluir las leyendas “CONTIENE CAFEÍNA EVITAR EN NIÑOS” o “CONTIENE EDULCORANTES – NO RECOMENDABLE EN NIÑOS”, deben ir en la parte superior derecha de la superficie principal de exhibición y en caso de que el producto preenvasado tenga sellos, deben ir debajo de los mismos, conforme se establece en el Apéndice A (Normativo).
4.6 Declaración de propiedades nutrimentales
4.6.1 No obstante lo establecido en la presente Norma Oficial Mexicana, toda declaración respecto de las propiedades nutrimentales debe sujetarse a lo dispuesto en la NOM-086-SSA1-1994 (ver 2.3 Referencias normativas).
4.7 Presentación de los requisitos obligatorios
4.7.1 Generalidades
4.7.1.1 Las etiquetas que ostenten los productos preenvasados deben fijarse de manera tal que permanezcan disponibles hasta el momento del consumo en condiciones normales, y deben aplicarse por cada unidad, envase múltiple o colectivo.
4.7.1.2 Cuando la información comercial obligatoria de los productos preenvasados que van destinados al consumidor final se encuentre en un envase múltiple o colectivo, no será necesario que dicha información aparezca en la superficie del producto individual. Sin embargo, la indicación del lote y la fecha de caducidad o de consumo preferente deben aparecer en el producto preenvasado individual. Además, en el producto preenvasado se debe indicar siempre en lo individual la leyenda “No etiquetado para su venta individual”, cuando éstos no tengan toda la información obligatoria o una frase equivalente.
4.7.1.3 Los datos que deben aparecer en la etiqueta deben indicarse con caracteres claros, visibles, indelebles y en colores contrastantes, fáciles de leer por el consumidor en circunstancias normales de compra y uso.
El dato relativo a lote, fecha de caducidad o de consumo preferente puede ser colocado en cualquier parte del envase.
4.7.1.4 Cuando el envase esté cubierto por una envoltura, debe figurar en ésta toda la información aplicable, a menos de que la etiqueta del envase pueda leerse fácilmente a través de la envoltura exterior.
4.7.1.5 Deben aparecer en la superficie principal de exhibición del producto cuando menos la marca, la declaración de cantidad, la denominación del producto preenvasado, el etiquetado frontal y aquella cuya ubicación se haya especificado. El resto de la información a que se refiere esta Norma Oficial Mexicana, puede incorporarse en cualquier otra parte del envase.
4.8 Idioma
4.8.1 El producto preenvasado debe ostentar la información obligatoria a que se refiere esta Norma Oficial Mexicana en idioma español, sin perjuicio de que se exprese en otros idiomas. Cuando la información obligatoria se exprese en otros idiomas debe aparecer también en español, de conformidad con lo establecido en la presente Norma Oficial Mexicana.
4.8.2 La presentación de información o representación gráfica adicional en la etiqueta a la señalada en esta Norma Oficial Mexicana, que puede estar presente en otro idioma, es facultativa y, en su caso, no debe sustituir, sino añadirse a los requisitos de etiquetado de la presente Norma Oficial Mexicana, siempre y cuando dicha información resulte necesaria para evitar que se induzca a error o engaño al consumidor.
5. Cálculos
5.1. Cálculo de Nutrimentos
5.1.1. Cálculos de energía
La cantidad de energía que debe declararse debe calcularse utilizando los siguientes factores de conversión:
| Nutriente | Conversión |
| hidratos de carbono disponibles | 4 kcal/g – 17 kJ/g |
| Proteínas | 4 kcal/g – 17 kJ/g |
| Grasas | 9 kcal/g – 37 kJ/g |
| Alcohol (etanol) | 7 kcal/g – 29 kJ/g |
Polioles (*) (sorbitol, xilitol, maltitol, isomaltitol, lactitol, manitol) | 2.4 kcal/g – 10 kJ/g |
| Eritritol (*) | 0 kcal/g – 0 kJ/g |
| Alulosa (*) | 0 kcal/g – 0 kJ/g |
| Tagatosa (*) | 1.5 kcal/g – 6.276 kJ/g |
(*) Cuando se hace un cálculo teórico del contenido energético se deben usar los factores de conversión específicos para polioles, eritritol, tagatosa y alulosa y no calcularse dentro de los hidratos de carbono disponibles.
5.1.2 Cálculo de proteínas
La cantidad de proteínas que ha de indicarse, debe calcularse utilizando la siguiente fórmula:
Proteína = contenido total de nitrógeno Kjeldahl X 6,25
5.1.3 Podrá usarse un factor diferente para el cálculo de proteína de acuerdo a lo establecido en el ordenamiento jurídico aplicable.
6. Declaraciones de Propiedades
6.1 Se prohíbe el uso de las siguientes declaraciones
6.1.1 De propiedades
- Declaraciones que hagan suponer que una alimentación equilibrada a base de alimentos ordinarios no puede suministrar cantidades suficientes de todos los elementos nutritivos.
- Declaraciones que no pueden comprobarse.
- Declaraciones sobre la utilidad de un alimento o bebida no alcohólica, para prevenir, aliviar, tratar o curar una enfermedad, trastorno o estado fisiológico.
- Declaraciones que pueden suscitar dudas sobre la inocuidad de alimento o bebidas no alcohólicas análogos, o puedan suscitar o provocar miedo en el consumidor.
- Declaraciones que afirmen que un determinado alimento constituye una fuente adecuada de todos los nutrimentos esenciales.
6.1.1 De propiedades potencialmente engañosas
A continuación se presentan ejemplos de declaraciones de propiedades que pueden ser engañosas:
- Declaraciones de propiedades que carecen de sentido, incluidos los comparativos y superlativos incompletos.
- Declaraciones de propiedades respecto a prácticas correctas de higiene o comercio, tales como: “genuinidad”, “salubridad”, “sanidad”, “sano”, “saludable”, excepto las señaladas en otros ordenamientos jurídicos aplicables.
6.2 Declaraciones de propiedades condicionales
Se permiten las siguientes declaraciones de propiedades condicionadas a la particular condición asignada a cada una de ellas:
- Puede indicarse que un alimento ha adquirido un valor nutritivo especial o superior gracias a la adición de nutrimentos, tales como vitaminas, nutrimentos inorgánicos (minerales) y aminoácidos, sólo si dicha adición ha sido hecha sobre la base de consideraciones nutrimentales de acuerdo con el marco jurídico aplicable.
- Las indicaciones de que el alimento tiene cualidades nutricionales especiales gracias a la reducción u omisión de un nutrimento, se deberán hacer sobre la base de consideraciones nutrimentales y estar sujetas al marco jurídico aplicable.
- Términos como “orgánico”, “ecológico”. “biológico” y las denominaciones con prefijos “bio” y “eco”, deben ajustarse a lo establecido en la Ley de Productos Orgánicos (ver Bibliografía), y aplicar los demás términos que se establezcan en alguna otra Norma Oficial Mexicana o marco jurídico aplicable. El uso de estos términos debe estar en consonancia con las prohibiciones establecidas en el numeral 6.1 Se prohíbe el uso de las siguientes declaraciones.
- Declaraciones de propiedades que afirmen que el alimento tiene características especiales cuando todos los alimentos de ese tipo tienen esas mismas características, si este hecho es aparente en la declaración de propiedades.
- Pueden utilizarse declaraciones de propiedades que destaquen la ausencia o no adición de determinadas sustancias a los alimentos, siempre que no sean engañosas y la sustancia:
- no esté sujeta a requisitos específicos en ninguna norma;
- sea una de las que los consumidores esperan encontrar normalmente en el alimento;
- no haya sido sustituida por otra que confiera al alimento características equivalentes a menos que la naturaleza de la sustitución se declare explícitamente con igual prominencia; y
- sea un ingrediente cuya presencia o adición en el alimento esté permitida.
- Las declaraciones de propiedades que pongan de relieve la ausencia o no adición de uno o más nutrimentos deberán considerarse como declaraciones de propiedades nutrimentales y, por consiguiente, deberán ajustarse a la declaración obligatoria de nutrimentos, estipulada en el marco jurídico aplicable.
- Puede declararse la preparación ritual o religiosa de un alimento (ejemplo, Halal, Kosher), siempre que se ajuste a las exigencias de las autoridades religiosas o del ritual competente y sin importar la presencia de sellos de advertencia.
6.3 Declaraciones nutrimentales y saludables
Este tipo de declaraciones pueden referirse al valor de energía, proteínas, hidratos de carbono, grasas y los derivados de las mismas, fibra dietética, sodio, vitaminas y nutrimentos inorgánicos (minerales) para los cuales se han establecido valores nutrimentales de referencia.
Sin embargo, en el caso de que el producto preenvasado incluya en su etiquetado alguno de los sellos señalados en 4.5.3.4.1 y cualquiera de las leyendas establecidas en 7.1.3 y 7.1.4, la declaración de propiedades nutrimentales y saludables debe cumplir con lo siguiente:
- no deben realizarse declaraciones de propiedades saludables;
- no deben realizarse declaraciones de propiedades nutrimentales relacionadas directamente con el sello que haya sido declarado en la etiqueta, y
- las declaraciones de propiedades nutrimentales que pueden realizarse deben ostentarse en la superficie de información con una altura máxima de la letra que debe corresponder con la altura mínima de la letra establecida en 4.1.3 de la NOM-030-SCFI-2006 (ver 2.2 Referencias Normativas).
6.3.1 Por declaración de propiedades relativas al contenido de nutrimentos se entiende una declaración de propiedades nutrimentales que describe el nivel de un determinado nutrimento contenido en un alimento. (Ejemplos: “Fuente de calcio”; “alto contenido de fibra y bajo en grasa”.)
6.3.2 Por declaración de propiedades de comparación de nutrimentos se entiende una declaración de propiedades que compara los niveles de nutrimentos y/o el valor energético de dos o más alimento. (Ejemplos: “reducido”; “menos que”; “menos”; “aumentado”; “más que”.)
6.3.3 Declaración de propiedades saludables significa cualquier representación que declara, sugiere o implica que existe una relación entre un alimento, o un constituyente de dicho alimento, y la salud. Las declaraciones de propiedades saludables incluyen lo siguiente:
6.3.3.1 Por declaración de función de los nutrimentos se entiende una declaración de propiedades nutrimentales que describe la función fisiológica del nutrimento en el crecimiento, el desarrollo y las funciones normales del organismo.
Ejemplo: “El nutrimento A (nombrando un papel fisiológico del nutrimento A en el organismo respecto al mantenimiento de la salud y la promoción del crecimiento y del desarrollo normal). El alimento X es una fuente del/alto en el nutrimento A”.
6.3.3.2 Otras Declaraciones de propiedades de función – Estas declaraciones de propiedades conciernen efectos benéficos específicos del consumo de alimento o sus constituyentes en el contexto de una dieta total sobre las funciones o actividades biológicas normales del organismo. Tales declaraciones de propiedades se relacionan a una contribución positiva a la salud o a la mejora de una función o la modificación o preservación de la salud. Ejemplo: “La sustancia A (nombrando los efectos de la sustancia A sobre el mejoramiento o modificación de una función fisiológica o la actividad biológica asociada con la salud). El alimento Y contiene X gramos de sustancia A”.
6.3.4 No se podrán hacer declaraciones de propiedades cuando se pretenda atribuir al producto características que no contiene o posee ni declaraciones asociadas a la disminución o reducción de riesgo de enfermedad.
7. Leyendas
7.1.1 Las leyendas precautorias deben hacer referencia al ingrediente u origen del ingrediente que, basado en información científica reconocida, se asocie a riesgos reales o potenciales relacionados con la intolerancia digestiva, alergias o enfermedades metabólicas o toxicidad.
7.1.2 Las leyendas precautorias específicas por producto, se establecerán en las normas oficiales mexicanas correspondientes u otros ordenamientos jurídicos.
7.1.3 Si la lista de ingredientes incluye edulcorantes, se debe colocar la leyenda precautoria frontal en letras mayúsculas “CONTIENE EDULCORANTES, NO RECOMENDABLE EN NIÑOS”.
![]()
7.1.4. Cuando el producto preenvasado contenga cafeína adicionada dentro de la lista de ingredientes en cualquier cantidad, se debe incluir la leyenda precautoria en letras mayúsculas “CONTIENE CAFEÍNA EVITAR EN NIÑOS”, la cual forma parte del sistema de etiquetado frontal, conforme se establece en el Apéndice A (Normativo).
![]()
8. Verificación y Vigilancia
La verificación y vigilancia de la presente Norma Oficial Mexicana se llevará a cabo por la Procuraduría Federal del Consumidor, la Comisión Federal para la Protección contra Riesgos Sanitarios y las dependencias competentes, en el ámbito de sus respectivas competencias, de acuerdo con la Ley Federal de Protección al Consumidor, la Ley General de Salud, la Ley Federal sobre Metrología y Normalización y demás ordenamientos jurídicos aplicables.
9. Procedimiento para la Evaluación de la Conformidad
La evaluación de la conformidad de la Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado para alimento y bebidas no alcohólicas preenvasados-Información comercial y sanitaria, objeto de la presente Norma Oficial Mexicana, no es certificable y se puede llevar a cabo a través de un esquema voluntario, por personas acreditadas y aprobadas en términos de lo dispuesto por la Ley Federal sobre Metrología y Normalización (LFMN) y su Reglamento, de acuerdo con lo descrito en el Procedimiento para la Evaluación de la Conformidad que a continuación se describe.
9.1 Introducción
El presente procedimiento establece las directrices que deben observar los productores y comercializadores que de manera voluntaria pretendan demostrar el cumplimiento con esta Norma Oficial Mexicana.
El presente procedimiento toma como base los procedimientos descritos en la norma internacional ISO/IEC 17020:2012, Evaluación de la conformidad: Requisitos para el funcionamiento de diferentes tipos de organismos que realizan la inspección, así como con la NMX-EC-17020-IMNC-2014 (ver 9.3.2 Referencias Normativas).
9.2Objetivo y campo de aplicación
Este Procedimiento para la Evaluación de la Conformidad, tiene por objeto establecer los requisitos que deben seguir las personas acreditadas y aprobadas en términos de lo dispuesto por la Ley Federal sobre Metrología y Normalización y su Reglamento, para evaluar el cumplimiento de la presente Norma Oficial Mexicana de los productos preenvasados, de fabricación nacional y extranjera, destinados al consumidor final en el territorio nacional.
9.3Referencias Normativas
Es indispensable la aplicación de los documentos vigentes siguientes o los que los sustituyan, para las finalidades del presente procedimiento para la evaluación de la conformidad, en los términos en que son referidas:
9.3.1 NMX-Z-12/2-1987, Muestreo para la inspección por atributos-Parte 2: Métodos de muestreo, tablas y gráficas, fecha de publicación en el Diario Oficial de la Federación el 1987-10-28.
9.3.2 NMX-EC-17020-IMNC-2014, Evaluación de la conformidad – Requisitos para el funcionamiento de diferentes tipos de unidades (organismos) que realizan la verificación (inspección), publicada su Declaratoria de Vigencia el 6 de junio de 2014.
9.3.3 Ley Federal sobre Metrología y Normalización.
9.3.4 ISO/IEC 17020:2012, Evaluación de la conformidad: Requisitos para el funcionamiento de diferentes tipos de organismos que realizan la inspección
9.3.5 Reglamento de la Ley Federal sobre Metrología y Normalización.
9.4 Términos y definiciones
Para los efectos de éste Procedimiento para la Evaluación de la Conformidad, se entiende por:
9.4.1 comercialización
es la actividad de compra y venta de los alimentos y a todas las bebidas no alcohólicas preenvasados de fabricación nacional y extranjera, dentro del territorio nacional.
9.4.2 dictamen
documento que se emite a los importadores como resultado de la evaluación de la conformidad efectuada durante la visita de verificación realizada en sitio, en el que se evidencia el cumplimiento, no cumplimiento o no sujeto al cumplimiento de los requisitos establecidos en la NOM-051-SCFI/SSA1-2010, cuando sea aplicable de conformidad con el procedimiento establecido en el numeral 6 del Anexo 2.4.1 del Acuerdo por el que la Secretaría de Economía emite reglas y criterios de carácter general en materia de Comercio Exterior publicado en el Diario Oficial de la Federación el 31 de diciembre de 2012 y sus modificaciones.
9.4.3 muestreo para el dictamen de información comercial
unidades o piezas de producto preenvasado, para su dictamen de etiqueta de información comercial.
9.4.4 Norma Oficial Mexicana (NOM)
la regulación técnica de observancia obligatoria expedida por las dependencias competentes, conforme a las finalidades establecidas en el artículo 40 de la Ley Federal sobre Metrología y Normalización, que establece reglas, especificaciones, atributos, directrices, características o prescripciones aplicables a un producto, proceso, instalación, sistema, actividad, servicio o método de producción u operación, así como aquellas relativas a terminología, simbología, embalaje, marcado o etiquetado y las que se refieran a su cumplimiento o aplicación.
9.4.5 lote
la cantidad de un producto elaborado en un mismo ciclo, integrado por unidades homogéneas e identificado con un código específico.
9.4.6 evaluación de la conformidad (EC)
es la determinación del grado de cumplimiento con la Norma Oficial Mexicana, comprende, entre otros, los procedimientos de muestreo, prueba y verificación.
9.4.7 unidad de verificación UV
la persona física o moral acreditada y aprobada, que realiza actos de verificación de un producto preenvasado.
9.4.8 constancia
documento que se emite a los productores, fabricantes, importadores, comercializadores o prestadores de servicios como resultado de la evaluación de la conformidad realizada a una etiqueta en el que se evidencia el cumplimiento, no cumplimiento o no sujeto al cumplimiento de los requisitos establecidos en la NOM-051SCFI/SSA1-2010, cuando sea aplicable de conformidad con el procedimiento establecido en el numeral 6 del Anexo 2.4.1 del Acuerdo por el que la Secretaría de Economía emite reglas y criterios de carácter general en materia de Comercio Exterior.
9.5 Constancia o Dictamen de cumplimiento de información comercial
9.5.1 Para emitir el dictamen o constancia de cumplimiento respecto de la información comercial, la unidad de verificación (UV) acreditada y aprobada en términos de la LFMN, debe llevar a cabo la constatación ocular de la información comercial correspondiente a los capítulos: 4, 5, 6 y 7 de la presente Norma Oficial Mexicana.
Lo anterior, sin menoscabo de las facultades de verificación y vigilancia de las autoridades competentes.
9.5.2 Disposiciones generales
El interesado puede solicitar a la UV los requisitos o la información necesaria para que su producto preenvasado, que se vaya a comercializar en territorio nacional cumpla con la presente Norma Oficial Mexicana.
9.5.3 El personal de la UV es el responsable de llevar a cabo el muestreo en el caso del dictamen de cumplimiento (ver 9.3.1 Referencias Normativas de este Procedimiento), y la constancia ocular en el caso de la constancia de conformidad para la verificación de información comercial.
9.5.4 Cuando un producto preenvasado cumpla con la presente Modificación de Norma Oficial Mexicana, se puede emitir la constancia de conformidad o dictamen de cumplimiento de información comercial únicamente si cumple con lo indicado en los capítulos 4, 5, 6 y 7 de la presente Norma Oficial Mexicana por parte de la UV.
9.6 Vigilancia
La verificación y vigilancia del presente Procedimiento para la Evaluación de la Conformidad se llevará a cabo de conformidad con lo establecido en la Ley Federal sobre Metrología y Normalización y su Reglamento.
9.7 Concordancia del procedimiento de evaluación de la conformidad con normas y lineamientos internacionales
El presente procedimiento toma como base los procedimientos descritos en la norma internacional ISO/IEC 17020:2012, Evaluación de la conformidad: Requisitos para el funcionamiento de diferentes tipos de organismos que realizan la inspección
9.8 Bibliografía del procedimiento de evaluación de la conformidad
9.8.1 NMX-EC-17020-IMNC-2014, Evaluación de la conformidad – Requisitos para el funcionamiento de diferentes tipos de unidades (organismos) que realizan la verificación (inspección), publicada su Declaratoria de Vigencia el 6 de junio de 2014.
10. Concordancia con Normas Internacionales
Esta Norma Oficial Mexicana es no equivalente (NEQ) con respecto a las normas Codex siguientes:
- CODEX STAN 1-1985, Rev.1-1991. Norma General para el Etiquetado de los Productos preenvasados, y sus respectivas enmiendas.
- CAC/GL 1-1979, Rev. 1-1991. Directrices generales sobre declaraciones de propiedades, y sus respectivas enmiendas.
- CAC/GL 2-1985, Rev. 2018. Directrices sobre Etiquetado Nutricional, y sus respectivas enmiendas.
- CAC/GL 23-1997, Rev. 1-2004. Directrices para el uso de declaraciones nutricionales y saludables, y sus respectivas enmiendas.
APÉNDICE A
(Normativo)
Características de los sellos
A.1 Componentes gráficos del sello
El sello está constituido como se describe en la figura A1.
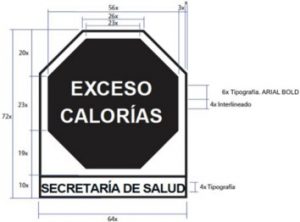
- Octágono color negro que contiene la leyenda
- Margen blanco sobre el contorno del octágono
- Fondo cuadro blanco
- Leyenda
- Firma de la Secretaría de Salud
Figura A1-Componentes del sello
A.2 Color y tipografía de los componentes gráficos del sello
A.2.1 El color de la tipografía sobre el fondo negro debe ser blanca y sobre el fondo blanco negra.
A.2.2 La tipografía a utilizar es Arial Bold en los textos dentro de los octágonos, y Arial en negrillas para las leyendas “CONTIENE CAFEÍNA EVITAR EN NIÑOS” y “CONTIENE EDULCORANTES, NO RECOMENDABLE EN NIÑOS” y para la firma “SECRETARÍA DE SALUD”.
A.3 Tamaño del sello
A.3.1 El tamaño del o de los sellos debe sujetarse a las especificaciones establecidas en la Tabla A.1.
Tabla A1-Tamaño de los sellos
| Área de la superficie principal de exhibición | Tamaño de cada sello |
| ≤ 5 cm2 | Al menos el 15% de la superficie principal de exhibición |
| > 5 cm2 a ≤ 30 cm2 | 1 cm de ancho x 1.11 cm de alto |
| > 30 cm2 a ≤ 40 cm2 | 1.5 cm de ancho x 1.66 cm de alto |
| > 40 cm2 a ≤ 60cm2 | 1.5 cm de ancho x 1.66 cm de alto |
| > 60 cm2 a ≤ 100 cm2 | 2.0 cm de ancho x 2.22 cm de alto |
| > 100 cm2 y ≤ 200 cm2 | 2.5 cm de ancho x 2.77 cm de alto |
| > 200 cm2 a ≤ 300 cm2 | 3.0 cm de ancho x 3.32 cm de alto |
| > 300 cm2 | 3.5 cm de ancho x 3.88 cm de alto |
A.3.2 En aquellos productos cuya superficie principal de exhibición sea ≤ 20 cm2 se debe usar las leyendas “CONTIENE CAFEÍNA EVITAR EN NIÑOS” y “CONTIENE EDULCORANTES, NO RECOMENDABLE EN NIÑOS”, y pueden estar sin recuadro al que hace referencia el numeral A.5. y con las siguientes características:
- Tipografía: Arial Bold.
- Color: Negro o blanco, debiendo contrastar con el fondo
- Tamaño: Altura mínima correspondiente al mínimo establecido para el contenido neto.
A.4 Proporción de los componentes gráficos del sello
El sello debe cumplir con las proporciones conforme se muestra en la Figura A2.

Figura A2-Proporciones del sello 1
A.4.1 La letra “x” corresponde a la unidad de proporción sobre la que se construye el ícono del sello
A.4.2 El mensaje contenido en los sellos “EXCESO CALORÍAS”, “EXCESO AZÚCARES”, “EXCESO GRASAS SATURADAS”, “EXCESO GRASAS TRANS”, “EXCESO SODIO” debe cubrir completamente el área de 23x.
A.4.3 Por otro lado “SECRETARÍA DE SALUD” debe abarcar completamente el área de 7x de la parte inferior del sello
A.4.4 Para el sello correspondiente con el número sellos debe distribuirse como se muestra en la figura A3.
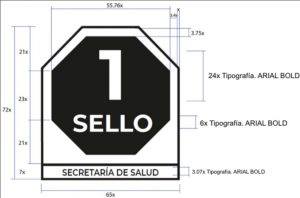
Figura A3. Proporciones del sello 3
A.5 De la leyenda “CONTIENE CAFEÍNA EVITAR EN NIÑOS”
La tipografía y colores corresponden al de los sellos expresados en el punto A.2. La leyenda debe cumplir con las especificaciones de la Figura A4.


Figura A4. Proporciones de la leyenda
A.6 De la leyenda “CONTIENE EDULCORANTES, NO RECOMENDABLE EN NIÑOS”
 Figura A5. Proporciones de la leyenda
Figura A5. Proporciones de la leyenda
A.7 Etiquetado de más de un sello
Los alimentos y las bebidas no alcohólicas preenvasados que deban utilizar más de un sello deben hacerlo conforme con los ejemplos siguientes:
- Uso de dos sellos

- Uso de tres sellos

- Uso de cuatro sellos

- Uso de cinco sellos
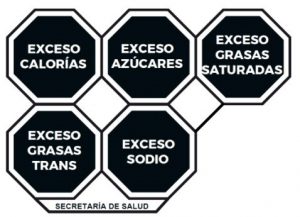
A.8 Ejemplos de inclusión de los sellos en la etiqueta Ejemplo con sellos frontales de 3 x 3 cm

Ejemplo con sellos frontales de 1.5 x 1.5 cm

Ejemplo con sellos frontales de 1 x1 cm

11. Bibliografía
- Ley General de Salud, publicada en el Diario Oficial de la Federación el 7 de febrero de 1984 y sus reformas.
- Ley Federal de Protección al Consumidor, publicada en el Diario Oficial de la Federación el 24 de diciembre de 1992 y sus reformas.
- Ley Federal sobre Metrología y Normalización, publicada en el Diario Oficial de la Federación, publicada en el Diario Oficial de la Federación el 1 de julio de 1992 y sus reformas.
- Ley de Productos Orgánicos, publicada en el Diario Oficial de la Federación el 7 de febrero de 2006.
- Reglamento de la Ley de Productos Orgánicos, publicado en el Diario Oficial de la Federación el 1 de abril de 2010.
- Reglamento de Control Sanitario de Productos y Servicios, publicado en el Diario Oficial de la Federación el 9 de agosto de 1999.
- Reglamento de la Ley Federal sobre Metrología y Normalización publicado en el Diario Oficial de la Federación el 14 de enero de 1999 y sus reformas.
- ACUERDO por el que se determinan los aditivos y coadyuvantes en alimentos, bebidas y suplementos alimenticios, su uso y disposiciones sanitarias, publicado en el Diario Oficial de la Federación el 16 de julio de 2012.
- ACUERDO por el que se dan a conocer los Lineamientos para la Operación Orgánica de las actividades agropecuarias, publicado en el Diario Oficial de la Federación el 29 de octubre de 2013.
- NMX-EC-17067-IMNC-2018 Evaluación de la conformidad-Fundamentos de la certificación de producto y directrices para los esquemas de certificación de producto (Cancela a la NMX-EC-067-IMNC-2007). Declaratoria de vigencia publicada en el Diario oficial de la Federación el 30 de agosto de 2018.
- ISO/IEC Guide 37 1995 (E) Instructions for use of products of consumer interest.
- Bourges H, Casanueva E y Rosado J.L Recomendaciones de ingestión de nutrimentos para la población mexicana. Bases Fisiológicas. Editorial Médica Panamericana. 2005.
- Joint FAO/WHO Expert Consultation on Human Vitamin and Mineral. Requirements vitamin and mineral requirements in human nutrition. Second edition. World Health Organization and Food and Agriculture Organization of the United Nations.
- Bourges H. La vitamina D, nutrimento clave para la salud humana, y su estado general en la población mexicana. Salud Pública de México 2018; 60(4).
- Organización Panamericana de la Salud. Modelo de Perfil de Nutrientes. Washington, DC.; 2016.
- Secretaría de Gobernación. Cámara de Diputados del H. Congreso de la Unión, Secretaría General, Secretaría de Servicios Parlamentarios. LEY DEL IMPUESTO ESPECIAL SOBRE PRODUCCIÓN Y SERVICIOS. Nueva Ley publicada en el Diario Oficial de la Federación el 30 de diciembre de 1980 [Internet]. Diario Oficial de la Federación; Available from: http://www.diputados.gob.mx/LeyesBiblio/pdf/78_281218.pdf
- World Health Organization. Glosario de términos de alcohol y drogas. Madrid: Ministerio de Sanidad y Consumo; 1994.
- World Health Organization. A FRAMEWORK FOR IMPLEMENTING THE SET OF RECOMMENDATIONS on the marketing of foods and non-alcoholic beverages to children [Internet]. Geneva; 2012. Available from: http://www.who.int/about/licensing/
- Organización Mundial de la Salud (OMS); Organización Panamericana de la Salud (OPS). Alimentos y bebidas ultraprocesados en América Latina: tendencias, efecto sobre la obesidad e implicaciones para las políticas públicas. Departamento de Enfermedades no Transmisibles y Salud Mental. 2015.
- Agriculture USD of. Scientific Report of the 2015 Dietary Guidelines Advisory Committee Advisory Report to the Secretary of Health and Human Services and the Secretary of Agriculture.
- World Health Organization. Sugars intake for adults and children [Internet]. Agro Food Industry Hi-Tech. 2015. p. 1–59. Available from: http://apps.who.int/iris/bitstream/10665/149782/1/9789241549028_eng.pdf?ua=1
- Ministerio de Salud de Chile. DIRECTRIZ PARA LA VIGILANCIA Y FISCALIZACION DE LA COMPOSICIÓN NUTRICIONAL DE LOS ALIMENTOS Y SU PUBLICIDAD, DE ACUERDO AL REGLAMENTO SANITARIO DE LOS ALIMENTOS. Departamento de Nutrición y Alimentos División de Políticas Públicas Saludables y Promoción Subsecretaría de Salud Pública; 2016.
- Kaur A, Scarborough P, Rayner M. A systematic review, and meta-analyses, of the impact of health-related claims on dietary choices. Int J Behav Nutr Phys Act. 2017;14(1):1-17. doi:10.1186/s12966-017-0548-1
- Interim A, Baseline N. Building Better Business for Children.
- World Cancer Research Fund, American Institute for Cancer Research. Continuous Update Project Expert Report 2018. Diet, nutrition and physical activity: Energy balance and body fatness. dietandcancerreport.org.
- OMS, FAO. Aprobación de nueva ley de alimentos en Chile. 2017. fao.org/publications.
- Bonvecchio-Arenas A, Fernández-Gaxiola AC, Belausteguigoitia MP, Kaufer-Horwitz M, Pérez Lizaur AB, Rivera Dommarco JÁ. Guías Alimentarias y de Actividad Física.; 2015.
- Fernández-gaxiola AC. Y de Actividad Física.; 2015.
- Arti Bhimjiyani, Andre Knuchel-Takano DH. Obesity Is a Major Cause. Cancer Res UK. 2016:35. https://www.cancerresearchuk.org/sites/default/files/tipping_the_scales_-_cruk_full_report11.pdf
- The Lancet Global Health. Stop industry interference, save lives. Lancet Glob Heal. 2019;7(12):e1584. doi:10.1016/S2214-109X(19)30469-3
- Cornelis MC, Byrne EM, Esko T, et al. Genome-wide meta-analysis identifies six novel loci associated with habitual coffee consumption. Mol Psychiatry. 2015;20(5):647-656. doi:10.1038/mp.2014.107
- Knight CA, Knight I, Mitchell DC. Beverage caffeine intakes in young children: In Canada and the US. Can J Diet Pract Res. 2006;67(2):96-99. doi:10.3148/67.2.2006.96
- Sylvetsky A, Rother KI, Brown R. NIH Public Access Author Manuscript Pediatr Clin North Am. Author manuscript; available in PMC 2012 December 1. Published in final edited form as: Artificial sweetener use among children: epidemiology, Pediatr Clin North Am. 2011 December?; 58(6): 1467–1. Pmc. 2012;58(6):1467-1480. doi:10.1016/j.pcl.2011.09.007.Artificial
- Convención L, Derechos L. La Convención sobre los Derechos del Niño. 1959.
- Bernstein JT, L’Abbé MR. Added sugars on nutrition labels: A way to support population health in Canada. Cmaj. 2016;188(15):E373-E374. doi:10.1503/cmaj.151081
- Warzak WJ, Evans S, Floress MT, Gross AC, Stoolman S. Caffeine consumption in young children. J Pediatr. 2011;158(3):508-509. doi:10.1016/j.jpeds.2010.11.022
- Schickenberg B, Van Assema P, Brug J, Verkaik-Kloosterman J, Ocké MC, De Vries NK. Replacing foods high in saturated fat by low-saturated fat alternatives: A computer simulation of the potential effects on reduction of saturated fat consumption. Br J Nutr. 2009;102(3):478-483. doi:10.1017/S0007114508190298
- Weihrauch MR, Diehl V. Artificial sweeteners – Do they bear a carcinogenic risk? Ann Oncol. 2004;15(10):1460-1465. doi:10.1093/annonc/mdh256
- Heatherley S V., Hancock KMF, Rogers PJ. Psychostimulant and other effects of caffeine in 9- to 11-year-old children. J Child Psychol Psychiatry Allied Discip. 2006;47(2):135-142. doi:10.1111/j.1469-7610.2005.01457.x
- Ley E, No Evaluación ley de alimentos no20.606. 2019;(6).
- Temple JL, Dewey AM, Briatico LN. Effects of Acute Caffeine Administration on Adolescents. Exp Clin Psychopharmacol. 2010;18(6):510-520. doi:10.1037/a0021651
- Kole J, Barnhill A. Caffeine Content Labeling: A Missed Opportunity for Promoting Personal and Public Health. J Caffeine Res. 2013;3(3):108-113. doi:10.1089/jcr.2013.0017
- Hartley TR, Sung BH, Pincomb GA, Whitsett TL, Wilson MF, Lovallo WR. Hypertension risk status and effect of caffeine on blood pressure. Hypertension. 2000;36(1):137-141. doi:10.1161/01.HYP.36.1.137
- Théodore FL, Tolentino-Mayo L, Hernández-Zenil E, et al. Pitfalls of the self-regulation of advertisements directed at children on Mexican television. Pediatr Obes. 2017;12(4):312-319. doi:10.1111/ijpo.12144
- Rosenfeld LS, Mihalov JJ, Carlson SJ, Mattia A. Regulatory status of caffeine in the United States. Nutr Rev. 2014;72(S1):23-33. doi:10.1111/nure.12136
- Romo-Romo A, Aguilar-Salinas CA, Brito-Córdova GX, Gómez-Díaz RA, Almeda-Valdes P. Sucralose decreases insulin sensitivity in healthy subjects: A randomized controlled trial. Am J Clin Nutr. 2018;108(3):485-491. doi:10.1093/ajcn/nqy152
- Bosman MJC, van der Merwe D, Ellis SM, Jerling JC, Badham J. South African adult metropolitan consumers’ opinions and use of health information on food labels. Br Food J. 2014;116(1):30-43. doi:10.1108/BFJ-12-2011-0298
- Golan E, Kuchler F, Mitchell L. Economics of Food Labeling. Orthop Surg. 2010;2(4):323. doi:10.1111/j.1757-7861.2010.00109.x
- Johnson RK, Lichtenstein AH, Anderson CAM, et al. Low-Calorie Sweetened Beverages and Cardiometabolic Health: A Science Advisory From the American Heart Association. Circulation. 2018;138(9):e126-e140. doi:10.1161/CIR.0000000000000569
- Malik VS, Hu FB. Sweeteners and risk of obesity and type 2 diabetes: The role of sugar-sweetened beverages. Curr Diab Rep. 2012;12(2):195-203.
- Malik VS, Hu FB. Sweeteners and risk of obesity and type 2 diabetes: The role of sugar-sweetened beverages. Curr Diab Rep. 2012;12(2):195-203. doi:10.1007/s11892-012-0259-6
- Conjunto UN, Para DEM. Eliminar del suministro mundial de alimentos las grasas trans de producción industrial. :1-8.A-HRC-26-31_sp (1).
- Roodenburg AJC, Schlatmann A, Dötsch-Klerk M, et al. Potential effects of nutrient profiles on nutrient intakes in the Netherlands, Greece, Spain, USA, Israel, China and South-Africa. PLoS One. 2011;6(2). doi:10.1371/journal.pone.0014721
- Corvalán C, Reyes M, Garmendia ML, Uauy R. Structural responses to the obesity and noncommunicable diseases epidemic: The Chilean Law of Food Labeling and Advertising. Obes Rev. 2013;14(S2):79-87. doi:10.1111/obr.12099
- Clifton PM, Keogh JB. A systematic review of the effect of dietary saturated and polyunsaturated fat on heart disease. Nutr Metab Cardiovasc Dis. 2017;27(12):1060-1080. doi:10.1016/j.numecd.2017.10.010
- Elfassy T, Yi S, Eisenhower D, Lederer A, Curtis CJ. Use of sodium information on the nutrition facts label in new york city adults with hypertension. J Acad Nutr Diet. 2015;115(2):278-283. doi:10.1016/j.jand.2014.08.027
- Mullee A, Romaguera D, Pearson-Stuttard J, et al. Association between Soft Drink Consumption and Mortality in 10 European Countries. JAMA Intern Med. 2019;179(11):1479-1490. doi:10.1001/jamainternmed.2019.2478
- Riley MW, Cochran DJ, Ballard JL. An investigation of preferred shapes for warning labels. Hum Factors. 1982;24(6):737-742. doi:10.1177/001872088202400610
- Hastings G. Why corporate power is a public health priority. BMJ. 2012;345(7871):1-5. doi:10.1136/bmj.e5124
- Sonnenberg L, Gelsomin E, Levy DE, Riis J, Barraclough S, Thorndike AN. A traffic light food labeling intervention increases consumer awareness of health and healthy choices at the point-of-purchase. Prev Med (Baltim). 2013;57(4):253-257. doi:10.1016/j.ypmed.2013.07.001
- Grigsby-Toussaint DS, Moise IK, Geiger SD. Observations of marketing on food packaging targeted to youth in retail food stores. Obesity. 2011;19(9):1898-1900. doi:10.1038/oby.2011.120
- Borgmeier I, Westenhoefer J. Impact of different food label formats on healthiness evaluation and food choice of consumers: A randomized-controlled study. BMC Public Health. 2009;9:1-12. doi:10.1186/1471-2458-9-184
- Sacks G, Veerman JL, Moodie M, Swinburn B. Traffic-light nutrition labelling and junk-food tax: A modelled comparison of cost-effectiveness for obesity prevention. Int J Obes. 2011;35(7):1001-1009. doi:10.1038/ijo.2010.228
- Corvalán C, Reyes M, Garmendia ML, Uauy R. Structural responses to the obesity and non-communicable diseases epidemic: Update on the Chilean law of food labelling and advertising. Obes Rev. 2019;20(3):367-374. doi:10.1111/obr.12802
- Temple and Why We Should Worry. Nutrition. 2010;33(6):793-806. doi:10.1016/j.neubiorev.2009.01.001.Caffeine
- Kanter R, Reyes M, Vandevijvere S, Swinburn B, Corvalán C. Anticipatory effects of the implementation of the Chilean Law of Food Labeling and Advertising on food and beverage product reformulation. Obes Rev. 2019;20(S2):129-140. doi:10.1111/obr.12870
- Feunekes GIJ, Gortemaker IA, Willems AA, Lion R, van den Kommer M. Front-of-pack nutrition labelling: Testing effectiveness of different nutrition labelling formats front-of-pack in four European countries. Appetite. 2008;50(1):57-70. doi:10.1016/j.appet.2007.05.009
- Crockett RA, Hollands GJ, Jebb SA, Marteau TM. Nutritional labelling for promoting healthier food purchasing and consumption. Cochrane Database Syst Rev. 2011;(9). doi:10.1002/14651858.cd009315
- Monteiro C, Cannon G, Moubarac J, Levy RB. Science and Politics of Nutrition Food for thought We should eat freshly cooked meals. Bmj. 2018;(June):361.
- Louie JCY, Moshtaghian H, Boylan S, et al. A systematic methodology to estimate added sugar content of foods. Eur J Clin Nutr. 2015;69(2):154-161. doi:10.1038/ejcn.2014.256
- Sylvetsky AC, Sciences N, Global SMR, et al. HHS Public Access. 2018;117(3):441-448. doi:10.1016/j.jand.2016.11.004.Consumption
- Mendoza R, Tolentino-Mayo L, Hernández-Barrera L, Nieto C, Monterrubio-Flores EA, Barquera S. Modifications in the consumption of energy, sugar, and saturated fat among the Mexican adult population: Simulation of the effect when replacing processed foods that comply with a front of package labeling system. Nutrients. 2018;10(1). doi:10.3390/nu10010101
- Shamah-Levy T, Cuevas-Nasu L, Gaona-Pineda EB, et al. Sobrepeso y obesidad en niños y adolescentes en México,actualización de la Encuesta Nacional de Salud y Nutrición de Medio Camino 2016. Salud Publica Mex. 2018;60(3, may-jun):244. doi:10.21149/8815
- Marrón-Ponce JA, Sánchez-Pimienta TG, Da Costa Louzada ML, Batis C. Energy contribution of NOVA food groups and sociodemographic determinants of ultra-processed food consumption in the Mexican population. Public Health Nutr. 2018;21(1):87-93.
- Sheiham A, James WPT. A new understanding of the relationship between sugars, dental caries and fluoride use: Implications for limits on sugars consumption. Public Health Nutr. 2013;17(10):2176-2184. doi:10.1017/S136898001400113X
- Kaufer-Horwitz M, Tolentino-Mayo L, Jáuregui A, et al. A front-of-pack labelling system for food and beverages for Mexico: A strategy of healthy decision-making. Salud Publica Mex. 2018;60(4):479-486. doi:10.21149/9615
- Su D, Zhou J, Jackson HL, Soliman GA, Huang TTK, Yaroch AL. A sex-specific analysis of nutrition label use and health, Douglas County, Nebraska, 2013. Prev Chronic Dis. 2015;12(9):1-14. doi:10.5888/pcd12.150167
- Scott C, Hawkins B, Knai C. Food and beverage product reformulation as a corporate political strategy. Soc Sci Med. 2017;172:37-45. doi:10.1016/j.socscimed.2016.11.020
- Pickering TG, Hall JE, Appel LJ, et al. Recommendations for blood pressure measurement in humans and experimental animals. Part 1: Blood pressure measurement in humans: A statement for professionals from the subcommittee of professional and public education of the American Heart Association council on high blood pressure research. Hypertension. 2005;45(1):142-161. doi:10.1161/01.HYP.0000150859.47929.8e
- Reeve B, Gostin LO. Big” food, tobacco, and alcohol: Reducing industry influence on noncommunicable disease prevention laws and policies comment on “addressing ncds: Challenges from industry market promotion and interferences. Int J Heal Policy Manag. 2019;8(7):450-454. doi:10.15171/ijhpm.2019.30
- Pearlman M, Obert J, Casey L. The Association Between Artificial Sweeteners and Obesity. Curr Gastroenterol Rep. 2017;19(12):1-8. doi:10.1007/s11894-017-0602-9
- Letona P, Chacon V, Roberto C, Barnoya J. Effects of licensed characters on children’s taste and snack preferences in Guatemala, a low/middle income country. Int J Obes. 2014;38(11):1466-1469. doi:10.1038/ijo.2014.38
- 2012. Guideline: Sodium intake for adults and children. World Heal Organ. 2012.
- Kanter R, Reyes M, Swinburn B, Vandevijvere S, Corvalán C. The food supply prior to the implementation of the chilean law of food labeling and advertising. Nutrients. 2019;11(1):1-10. doi:10.1038/ijo.2014.38
- International Diabetes Federetion Europe. IDF Europe position on added sugar. 2016;(April):1-10.
- Pincomb GA, Lovallo WR, Passey RB, Whitsett TL, Silverstein SM, Wilson MF. Effects of caffeine on vascular resistance, cardiac output and myocardial contractility in young men. Am J Cardiol. 1985;56(1):119-122. doi:10.1016/0002-9149(85)90578-8
- Cramer S. Food should be labelled with the exercise needed to expend its calories. BMJ. 2016;353(April):1-2. doi:10.1136/bmj.i1856
- Cabrera M, Machín L, Arrúa A, et al. Nutrition warnings as front-of-pack labels: Influence of design features on healthfulness perception and attentional capture. Public Health Nutr. 2017;20(18):3360-3371. doi:10.1017/S136898001700249X
- Sylvetsky AC, Conway EM, Malhotra S, Rother KI. Development of Sweet Taste Perception: Implications for Artificial Sweetener Use. Endocr Dev. 2017;32(November 2018):87-99. doi:10.1159/000475733
- Heckman MA, Weil J, de Mejia EG. Caffeine (1, 3, 7-trimethylxanthine) in foods: A comprehensive review on consumption, functionality, safety, and regulatory matters. J Food Sci. 2010;75(3). doi:10.1111/j.1750-3841.2010.01561.x
- World Health Organization. Guideline: Sugars Intake for Adults and Children. Ginebra; 2014. https://www.who.int/nutrition/publications/guidelines/sugars_intake/en/. Accessed February 9, 2019.
- Mozaffarian D, Angell SY, Lang T, Rivera JA. Role of government policy in nutrition-barriers to and opportunities for healthier eating. BMJ. 2018;361:1-11. doi:10.1136/bmj.k2426
- Arrúa A, Curutchet MR, Rey N, et al. Impact of front-of-pack nutrition information and label design on children’s choice of two snack foods: Comparison of warnings and the traffic-light system. Appetite. 2017;116:139-146. doi:10.1016/j.appet.2017.04.012
- Massri C, Sutherland S, Källestål C, Peña S. Impact of the food-labeling and advertising law banning competitive food and beverages in Chilean public schools, 2014–2016. Am J Public Health. 2019;109(9):1249-1254. doi:10.2105/AJPH.2019.305159
- Arrúa A, MacHín L, Curutchet MR, et al. Warnings as a directive front-of-pack nutrition labelling scheme: Comparison with the Guideline Daily Amount and traffic-light systems. Public Health Nutr. 2017;20(13):2308-2317. doi:10.1017/S1368980017000866
- Christoph MJ, Larson N, Laska MN, Neumark-Sztainer D. Nutrition Facts Panels: Who Uses Them, What Do They Use, and How Does Use Relate to Dietary Intake? J Acad Nutr Diet. 2018;118(2):217-228. doi:10.1016/j.jand.2017.10.014
- Mozaffarian D, Fahimi S, Singh GM, et al. Global sodium consumption and death from cardiovascular causes. N Engl J Med. 2014;371(7):624-634. doi:10.1056/NEJMoa1304127
- Ahluwalia N, Herrick K. Ahluwalia-2015-Caffeine intake from food and b. 2015:102-111. doi:10.3945/an.114.007401.102
- Pincomb GA, Lovallo WR, McKey BS, et al. Acute blood pressure elevations with caffeine in men with borderline systemic hypertension. Am J Cardiol. 1996;77(4):270-274. doi:10.1016/S00029149(97)89392-7
- Correa T, Fierro C, Reyes M, Dillman Carpentier FR, Taillie LS, Corvalan C. Responses to the Chilean law of food labeling and advertising: Exploring knowledge, perceptions and behaviors of mothers of young children. Int J Behav Nutr Phys Act. 2019;16(1):1-10. doi:10.1186/s12966-019-0781-x
- De la Cruz-Góngora V, Villalpando S, Rodríguez-Oliveros G, Castillo-García M, Mundo-Rosas V, Meneses-Navarro S. Use and understanding of the nutrition information panel of pre-packaged foods in a sample of Mexican consumers. Salud Publica Mex. 2012;54(2):158-166. doi:10.1590/S0036-36342012000200012
- Analisis de regulacion y practicas para el etiquetado de alimentos y bebidas para niños y adolescentes en algunos países de America Latina y recomendaciones para facilitar la información al consumidos. Nov. 2016. https://www.unicef.org/lac/20161120_UNICEF_LACRO_Etiquetado_Resumen_LR.pdf.
- Pincomb GA, Lovallo WR, Passey RB, Wilson MF. Effect of behavior state on caffeine’s ability to alter blood pressure. Am J Cardiol. 1988;61(10):798-802. doi:10.1016/0002-9149(88)91069-7
- Stern D, Tolentino L, Barquera S. Revisión del etiquetado frontal: Análisis de las Guías Diarias de Alimentación. 2011.
- Contreras-Manzano A, Jáuregui A, Velasco-Bernal A, et al. Comparative analysis of the classification of food products in the mexican market according to seven different nutrient profiling systems. Nutrients. 2018;10(6).
- Instituto Nacional de Salud Pública de México. Review of current labelling regulations and practices for food and beverage targeting children and adolescents in Latin America countries (Mexico, Chile, Costa Rica and Argentina) and recommendations for facilitating consumer information. United Nations Child Fund. 2016;(655). https://www.unicef.org/lac/sites/unicef.org.lac/files/201805/20161205_UNICEF_LACRO_Etiquetado_ING.pdf%0Ahttps://www.unicef.org/ecuador/english/20 161122_UNICEF_LACRO_Labeling_Report_LR(3).pdf.
- Sánchez-Pimienta TG, Batis C, Lutter CK, Rivera JA. Sugar-Sweetened Beverages Are the Main Sources of Added Sugar Intake in the Mexican Population. J Nutr. 2016;146(9):1888S-1896S. doi:10.3945/jn.115.220301
- Mandrioli D, Kearns CE, Bero LA. Relationship between research outcomes and risk of bias, study sponsorship, and author financial conflicts of interest in reviews of the effects of artificially sweetened beverages on weight outcomes: A systematic review of reviews. PLoS One. 2016;11(9):1-20. doi:10.1371/journal.pone.0162198
- Roodenburg AJC, van Ballegooijen AJ, Dötsch-Klerk M, van der Voet H, Seidell JC. Modelling of Usual Nutrient Intakes: Potential Impact of the Choices Programme on Nutrient Intakes in Young Dutch Adults. PLoS One. 2013;8(8). doi:10.1371/journal.pone.0072378
- Huang Y, Kypridemos C, Liu J, et al. Cost-Effectiveness of the US Food and Drug Administration Added Sugar Labeling Policy for Improving Diet and Health. Circulation. 2019:CIRCULATIONAHA.118.036751. doi:10.1161/CIRCULATIONAHA.118.036751
- De la Cruz-Góngora V, Torres P, Contreras-Manzano A, et al. Understanding and acceptability by Hispanic consumers of four front-of-pack food labels. Int J Behav Nutr Phys Act. 2017;14(1):1-12. doi:10.1186/s12966-017-0482-2
- Collin LJ, Judd S, Safford M, Vaccarino V, Welsh JA. Association of Sugary Beverage Consumption With Mortality Risk in US Adults: A Secondary Analysis of Data From the REGARDS Study. JAMA Netw open. 2019;2(5):e193121. doi:10.1001/jamanetworkopen.2019.3121
- Malik VS, Pan A, Willett WC, Hu FB. Sugar-sweetened beverages and weight gain in children and adults : Am J Clin Nutr. 2013;98:1084-1102. doi:10.3945/ajcn.113.058362.1
- Monteiro CA, Cannon G, Moubarac JC, Levy RB, Louzada ML, Jaime PC. We should eat freshly cooked meals. BMJ. 2018;362(July):3099. doi:10.1136/bmj.k3099
- Tolentino-Mayo L, Rincón-Gallardo Patiño S, Bahena-Espina L, Ríos V, Barquera S. Conocimiento y uso del etiquetado nutrimental de alimentos y bebidas industrializados en México. Salud Publica Mex. 2018;60(3, may-jun):328. doi:10.21149/8825
- Food Standards Australia & New Zeland. International sugar labelling approaches Executive summary.
- Crockett RA, Jebb SA, Hankins M, Marteau TM. The impact of nutritional labels and socioeconomic status on energy intake: An experimental field study. Appetite. 2014;81:12-19. doi:10.1016/j.appet.2014.05.024
- Ogle AD, Graham DJ, Lucas-Thompson RG, Roberto CA. Influence of Cartoon Media Characters on Children’s Attention to and Preference for Food and Beverage Products. J Acad Nutr Diet. 2017;117(2):265-270.
- Schnettler B, Ares G, Sepúlveda N, et al. How do consumers perceive reformulated foods after the implementation of nutritional warnings? Case study with frankfurters in Chile. Food Qual Prefer. 2019;74:179-188. doi:10.1016/j.foodqual.2019.01.021
- Stern D, Piernas C, Barquera S, Rivera JA, Popkin BM. C123-B-T901-MA-0034-01.pdf. 2014:949956. doi:10.3945/jn.114.190652.949
- Ni Mhurchu C, Eyles H, Choi YH. Effects of a voluntary front-of-pack nutrition labelling system on packaged food reformulation: The health star rating system in New Zealand. Nutrients. 2017;9(8). doi:10.3390/nu9080918
- Organización Mundial de la Salud, Organización de las Naciones Unidas para la Agricultura y la Alimentación. Dieta, Nutrición y Prevención de Enefermedades Crónicas.; 2003. https://www.who.int/nutrition/publications/obesity/WHO_TRS_916_spa.pdf.
- Ratificación de la declaratoria de emergencia epidemiológica EE-5-2018 para todas las entidades federativas de México ante la magnitud y trascendencia de los casos de sobrepeso y obesidad, para fortalecer y apuntalar las acciones de la estrategia nacional. 2018. http://www.cenaprece.salud.gob.mx/programas/interior/emergencias/descargas/pdf/1371.pdf.
- Díaz AA, Veliz PM, Rivas-Mariño G, Mafla CV, Altamirano LMM, Jones CV. Etiquetado de alimentos en Ecuador: Implementación, resultados y acciones pendientes. Rev Panam Salud Publica/Pan Am J Public Heal. 2017;41(2):1-8. doi:10.26633/rpsp.2017.54
- Toews I, Lohner S, Küllenberg De Gaudry D, Sommer H, Meerpohl JJ. Association between intake of non-sugar sweeteners and health outcomes: Systematic review and meta-analyses of randomised and non-randomised controlled trials and observational studies. BMJ. 2019;364. doi:10.1136/bmj.k4718
- Rapoport JL, Berg CJ, Ismond DR, Zahn TP, Neims A. Behavioral Effects of Caffeine in Children: Relationship Between Dietary Choice and Effects of Caffeine Challenge. Arch Gen Psychiatry. 1984;41(11):1073-1079. doi:10.1001/archpsyc.1983.01790220063010
- Hughes JR, Hale KL. Behavioral effects of caffeine and other methylxanthines on children. Exp Clin Psychopharmacol. 1998;6(1):87-95. doi:10.1037/1064-1297.6.1.87
- Monteiro Carlos CG. El Gran Tema De Nutrición Y Salud Pública En El Ultra-Procesamiento De Alimentos. World Nutr. 2012:19. www.wphna.org.
- Cecchini M, Warin L. Impact of food labelling systems on food choices and eating behaviours: A systematic review and meta-analysis of randomized studies. Obes Rev. 2016;17(3):201-210.doi:10.1111/obr.12364
- Mcginnis JM, Gootman JA, Kraak VI, Board N. Food Marketing to Children and Youth.; 2006. doi:10.17226/11514
- Ares G, Arrúa A, Antúnez L, et al. Influence of label design on children’s perception of two snack foods: Comparison of rating and choice-based conjoint analysis. Food Qual Prefer. 2016;53:1-8. doi:10.1016/j.foodqual.2016.05.006
- Patterson D, Buse K, Magnusson R, Toebes B. Identifying a human rights–based approach to obesity for States and civil society. Obes Rev. 2019;20(S2):45-56. doi:10.1111/obr.12873
- Reglamento Bromatológico Nacional aprobado por el Decreto N 315_994 DE 5 DE juLIO DE 1994. Ministerio de Salud de Uruguay.pdf.
- Cairns BG, Angus K, Hastings G. The extent, nature and effects of food promotion to children: a review of the evidence to prepared for the World Health Organization. World Heal Organ. 2009;(December).
- Organización Panamericana de la Salud O.P.S., Organización Mundial de la Salud O.M.S. Modelo de Perfil de Nutrientes de La Organización Panamericana de La Salud.; 2015. www.paho.org/permissions%0Ahttp://iris.paho.org/xmlui/bitstream/handle/123456789/18622/97892 75318737_spa.pdf.
- World Cancer Research Fund International. Building momentum: lessons on implementing a robust front-of-pack food label. WcrfOrg/Policy. 2019:44.
- Araya S, Elberg A, Noton C, Schwartz D. Identifying Food Labeling Effects on Consumer Behavior. SSRN Electron J. 2018;(2015):1-25. doi:10.2139/ssrn.3195500
- Morenga L Te, Mallard S, Mann J. Dietary sugars and body weight: Systematic review and meta-analyses of randomised controlled trials and cohort studies. BMJ. 2013;345(7891):1-25. doi:10.1136/bmj.e7492
- Crockett RA, King SE, Marteau TM, et al. Nutritional labelling for healthier food or non-alcoholic drink purchasing and consumption. Cochrane Database Syst Rev. 2018;2018(2). doi:10.1002/14651858.CD009315.pub2
- Nations U, Sachse M. Review of Current Labelling Regulations and Practices for Food and Beverage Targeting Children and Adolescents in Latin America Countries and Recommendations for Facilitating Consumer Information. Panamá: UNICEF; 2015.
- Stanhope K, Schwarz JM, Keim N, et al. Consuming fructose-sweetened, not glucose-sweetened, beverages increases visceral adiposity and lipids and decreases insulin sensitivity in overweight/obese humans. J Clin Invest. 2009;119(5):1322-1334. doi:10.1172/JCI37385DS1
- Vos MB, Kaar JL, Welsh JA, et al. Added sugars and cardiovascular disease risk in children: A scientific statement from the American Heart Association. Circulation. 2017;135(19):e1017-e1034. doi:10.1161/CIR.0000000000000439
- Durán Agüero S, Angarita Dávila L, Escobar Contreras MC, Rojas Gómez D, De Assis Costa J. Noncaloric Sweeteners in Children: A Controversial Theme. Biomed Res Int. 2018;2018. doi:10.1155/2018/4806534
- Paper FAOF. Fats and Fatty Acids in Human Nutrition. Report of an Expert Consultation. Vol 91.; 2010.
- Benjelloun S. Ultra-Processed Food and Drink Products in Morocco. Vol 63.; 2013. doi: http://dx.doi.org/10.1159/000354245
- Becker MW, Sundar RP, Bello N, Alzahabi R, Weatherspoon L, Bix L. Assessing attentional prioritization of front-of-pack nutrition labels using change detection. Appl Ergon. 2016;54:90-99. doi:10.1016/j.apergo.2015.11.014
- Afshin A, Sur PJ, Fay KA, et al. Health effects of dietary risks in 195 countries, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019;393(10184):19581972. doi:10.1016/S0140-6736(19)30041-8
- Lott M, Callahan E, Duffy EW, Story M, Daniels S. Healthy Beverage Consumption in Early Childhood: Recommendation from Key National Health and Nutrition Organizations. Consensus Statement. Heal Eat Res. 2019;1(1):1-13. doi:10.1017/CBO9781107415324.004
- Ministerio de Salud. DE LOS ALIMENTOS Y SU PUBLICIDAD Junio 2017 Subsecretaría de Salud Pública División de Políticas Públicas Saludables y Promoción Departamento de Nutrición y Alimentos. 2017:1-97.
- Barquera S, Sánchez-Bazan K, Carriedo A, Swinburn B. The Development of a National Obesity and Diabetes Prevention and Control Strategy in Mexico: Actors, Actions and Conflicts of Interest.; 2018.
- Khandpur N, de Morais Sato P, Mais LA, et al. Are front-of-package warning labels more effective at communicating nutrition information than traffic-light labels? A randomized controlled experiment in a Brazilian sample. Nutrients. 2018;10(6):1-15. doi:10.3390/nu10060688
- Morenga L Te, Montez JM. Health effects of saturated and trans-fatty acid intake in children and adolescents: Systematic review and meta-analysis. PLoS One. 2017;12(11). doi:10.1371/journal.pone.0186672
- Kelly B, Jewell J. What is the evidence on the policy specifications, development processes and effectiveness of existing front-of-pack food labelling policies in the WHO European Region? World Heal Organ -WHO. 2018:80.
- Herrera AMM, Crino M, Erskine HE, et al. Cost-effectiveness of product reformulation in response to the health star rating food labelling system in australia. Nutrients. 2018;10(5):1-16. doi:10.3390/nu10050614
- Romero-Martínez M, Shamah-Levy T, Cuevas-Nasu L, et al. Diseño metodológico de la encuesta nacional de salud y nutrición de medio camino 2016. Salud Publica Mex. 2017;59(3):299-305. doi:10.21149/8593
- Suez J, Korem T, Zeevi D, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature. 2014;514(7521):181-186. doi:10.1038/nature13793
- World Health Organization. Diet, Nutrition and the Prevention of Chronic Diseases.; 2002. doi:ISBN 92 4 120916 X ISSN 0512-3054 (NLM classification: QU 145)
ARTÍCULOS TRANSITORIOS
PRIMERO. Con el objeto de regular las disposiciones contenidas en el decreto por el que se reforman y adicionan diversas disposiciones de la Ley General de Salud relativas al etiquetado frontal de advertencia, los textos contenidos en los incisos 4.5.3.4 al 4.5.3.4.7 así como el 7.1.3 y 7.1.4 de la modificación a la NOM-051-SCFI/SSA1-2010, Especificaciones generales de etiquetado para alimentos y bebidas no alcohólicas preenvasados, información comercial y sanitaria, entrarán en vigor a partir del 1 de octubre de 2020, en tanto que el resto de los numerales o incisos de la modificación a la citada Norma Oficial Mexicana, lo harán el 1 de abril de 2021. Lo anterior con las precisiones que se detallan en los siguientes transitorios.
SEGUNDO. Para el cálculo y evaluación de los valores y perfiles referentes a la información nutrimental complementaria se establecerán progresivamente TRES FASES distintas, la última de las cuales se verificará a partir del 1 de octubre del año 2025, a saber:
PRIMERA FASE. Del 1 de octubre de 2020 al 30 de septiembre de 2023 (3 AÑOS), el cálculo y evaluación de la información nutrimental complementaria se realizará con los siguientes criterios y valores:
1.- Nutrimentos críticos añadidos al alimento o bebida no alcohólica preenvasado:
- Si se agregan azúcares añadidos, se deberán evaluar azúcares y calorías
- Si se agregan grasas, se deberán evaluar grasas saturadas, grasas trans y calorías
- Si se agrega sodio, sólo se deberá evaluar sodio
2.- Perfiles Nutrimentales Primera Fase.
Energía Azúcares Grasas saturadas Grasas trans Sodio Sólidos en 100 g de producto ≥ 275 kcal
totales
≥ 10 % del total de energía proveniente de azúcares libres
Se exceptúan de sellos las bebidas con < 10 kcal de
azúcares libres
≥ 10 % del total de energía proveniente de
grasas saturadas
≥ 1 % del total de energía
proveniente de
grasas trans
≥ 350 mg
Bebidas sin calorías:
≥ 45 mg
Líquidos en
100 mL de producto
≥ 70 kcal
totales o
≥ 10 kcal de
azúcares
libres
Leyenda a usar EXCESO CALORÍAS EXCESO AZÚCARES EXCESO
GRASAS
SATURADAS
EXCESO
GRASAS
TRANS
EXCESO SODIO Queda expresamente consignado que durante la PRIMERA FASE no estarán vigentes las especificaciones y criterios a que se refiere el numeral 4.5.3 de la modificación a la norma, ni tampoco los valores de la Tabla 6 referente a los Perfiles Nutrimentales.
SEGUNDA FASE. Del 1 de octubre de 2023 al 30 de septiembre de 2025 (2 AÑOS), el cálculo y evaluación de la información nutrimental complementaria se realizará con los siguientes criterios y valores:
1.- Nutrimentos críticos añadidos al alimento o bebida no alcohólica preenvasado:
- Si se agregan azúcares añadidos, se deberán evaluar azúcares y calorías
- Si se agregan grasas, se deberán evaluar grasas saturadas, grasas trans y calorías
- Si se agrega sodio, sólo se deberá evaluar sodio.
2.- Tabla 6 de la modificación a la norma relativa a los Perfiles Nutrimentales, misma que se reproduce a continuación:
Energía Azúcares Grasas saturadas Grasas trans Sodio Sólidos en 100 g de producto ≥ 275 kcal totales ≥ 10 % del total de energía
proveniente de azúcares libres
≥ 10 % del total de energía
proveniente de grasas saturadas
≥ 1 % del total de
energía
proveniente
de grasas trans
≥ 1 mg de sodio por kcal o
≥ 300 mg
Bebidas sin calorías:
≥ 45 mg de sodio
Líquidos en
100 mL de producto
≥ 70 kcal totales o
≥ 8 kcal de azúcares libres
Leyenda a usar EXCESO CALORÍAS EXCESO AZÚCARES EXCESO
GRASAS
SATURADAS
EXCESO
GRASAS
TRANS
EXCESO SODIO Durante la SEGUNDA FASE no estarán vigentes las especificaciones y criterios a que se refiere el numeral 4.5.3 de la modificación a la norma.
TERCERA FASE. A partir del 1 de octubre de 2025, el cálculo y evaluación de la información nutrimental complementaria se realizará aplicando íntegramente las disposiciones contenidas en los incisos 4.5.3, así como la Tabla 6 de la modificación a la norma relativa a los Perfiles Nutrimentales.
TERCERO. Los responsables de los productos preenvasados podrán emplear temporalmente adhesivos o calcomanías adheribles sobre la etiqueta de los productos, siempre que dichos adhesivos o calcomanías cumplan exactamente con las disposiciones contenidas en los incisos 4.5.3.4 al 4.5.3.4.7, 7.1.3 y 7.1.4, así como con lo previsto en el apéndice A (normativo). Esta alternativa sólo podrá ser utilizada hasta el 31 de marzo de 2021.
CUARTO. El inciso 4.1.5 entrará en vigor a partir del 1 de abril de 2021.
QUINTO. La Procuraduría Federal del Consumidor deberá emitir antes del 1 de octubre de 2020 los Lineamientos para el registro y reconocimiento de organizaciones o asociaciones profesionales que puedan emitir sellos o leyendas de recomendación para alimentos y bebidas no alcohólicas, y así dar cumplimiento a lo establecido en el inciso 4.1.4. El 27 de enero se emitió en el diario oficial el ACUERDO por el que se establecen los Lineamientos para el registro y reconocimiento de organizaciones o asociaciones profesionales que puedan emitir sellos o leyendas de recomendación para alimentos y bebidas no alcohólicas preenvasados. Consultar link más abajo.
SEXTO: Dentro de los 180 días naturales después de su publicación en el Diario Oficial de la Federación, la Secretaría de Economía y la Secretaría de Salud determinarán conjuntamente, y en el ámbito de sus respectivas competencias, los indicadores apropiados con datos cuantitativos o cualitativos que permitan evaluar y soportar técnicamente los resultados en la implementación de esta modificación. Cada una de las tres fases a que se refiere el transitorio Segundo, deberá ser evaluada por separado mediante la aplicación de tales indicadores a partir de que éstas se encuentren concluidas, en el entendido que la última será realizada con los datos obtenidos al 30 de septiembre de 2028.
Los resultados serán difundidos y de acceso público dentro de los seis meses siguientes a la conclusión de cada período.
Ciudad de México, a 26 de marzo de 2020.- El Director General de Normas y Presidente del Comité Consultivo Nacional de Normalización de la Secretaría de Economía, Alfonso Guati Rojo Sánchez.- Rúbrica.- El Comisionado Federal para la Protección contra Riesgos Sanitarios y Presidente del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, José Alonso Novelo Baeza.- Rúbrica.
Limitación de responsabilidad
Esta compilación fue realizada por www.novomanía.com y su spin-out www.nutrimonitor.com, es una versión beta hasta el 21 de mayo de 2021, y es proporcionada, tal como está, sin garantía de cualquier tipo y puede incluir errores, en ningún caso, Novomanía, será responsable ante usted o cualquier tercero por ningún daño especial, punitivo, incidental, indirecto o consecuente de cualquier tipo, o cualquier otro daño de cualquier tipo, incluyendo, mas no limitando, aquellos que deriven de un mal etiquetado, y de cualquier principio de responsabilidad que surja de o esté relacionado con el uso de este documento. El objetivo de este documento es orientar a las empresas, especialistas de alimentos y nutrición en la implantación de esta norma, les deseamos éxito. En ningún momento se pretende emular o sustituir a la autoridad.
Somos una empresa de ciencia de datos, enfocados en índices nutrimentales, etiquetados de advertencia y monitoreo tecnológico de alimentos a nivel global.
Si encuentran algún error, mucho les agradeceríamos enviarnos un correo a contacto@novomania.com para corregirlo en futuras versiones.
Relación histórica de la compilación:
Documento Fecha ACUERDO por el que se establecen los Lineamientos para el registro y reconocimiento de organizaciones o asociaciones profesionales que puedan emitir sellos o leyendas de recomendación para alimentos y bebidas no alcohólicas preenvasados.
https://www.dof.gob.mx/nota_detalle.php?codigo=5610442&fecha=27/01/2021
27-enero-2021 Se otorga prórroga hasta el 30 de noviembre del 2020, para no exhibir el sistema de etiquetado frontal de advertencia.
http://dof.gob.mx/nota_detalle.php?codigo=5597654&fecha=31/07/2020
31-julio-2020 Nota aclaratoria donde se corrigen algunos numerales y unidades de medida en tabla 4.
http://www.dof.gob.mx/nota_detalle.php?codigo=5595259&fecha=19/06/2020
19-junio-2020 El cambio de pilas a sellos: NOM-051-SCFI/SSA1-2010.
27-abril-2020 NOM-051-SCFI/SSA1-2010 La compilación más completa, que incluye modificaciones y notas aclaratorias anteriores.
http://www.economia-noms.gob.mx/normas/noms/2010/051scfissa1mod.pdf
25-noviembre-2016 Para conocer los Criterios para la implementación, verificación y vigilancia, así como para la evaluación de la conformidad de la Modificación a la Norma Oficial Mexicana NOM-051-SCFI/SSA1-2010, donde se indica que las autoridades verificarán a partir del 1 de abril de 2021. Consultar el acuerdo emitido 10-julio-2020:
http://www.dof.gob.mx/nota_detalle.php?codigo=5596558&fecha=10/07/2020
Manual de la MODIFICACIÓN a la Norma Oficial Mexicana NOM 051 SCFI SSA1 2010 publicado por COFEPRIS para facilitar su implementación (Fecha de publicación 21 de mayo de 2021):
https://www.gob.mx/cms/uploads/attachment/file/640335/Manual_de_la_M_NOM051SSA.pdf
Representación matemática de los Perfiles Nutrimentales, cortesía de Novomanía:
Energía Azúcares g Grasas saturadas g Grasas trans g Sodio mg 100 g Energía ≥ 275 4 Azúcares ≥ 10% Energía 9 Grasa Sat ≥ 10% Energía 9 Grasa Trans ≥ 10% Energía Sodio ≥ Energía
o
Sodio ≥ 300Bebidas sin calorías:Sodio ≥ 45100 mL Energía ≥ 70
o
4 azúcares libres ≥ 8
EXCESO
CALORÍASEXCESO
AZÚCARESEXCESO
GRASAS
SATURADASEXCESO
GRASAS TRANSEXCESO
SODIO
